
Wetenschap
Waarom geven droog natriumchloride en nitraatoplossingen allemaal dezelfde kleur in een vlamtest?
Natriumchloride (NaCl)
* De sleutelspeler: De fel oranje gele kleur die we zien in een natriumchloride-vlamtest is exclusief Vanwege de aanwezigheid van natriumionen (Na+) .
* Het mechanisme: Wanneer verwarmd, absorberen de natriumionen energie en worden opgewonden. Deze opgewonden toestand is onstabiel, dus de elektronen keren snel terug naar hun grondtoestand en brengen de overtollige energie als licht vrij. Dit licht wordt uitgezonden bij een specifieke golflengte, die onze ogen beschouwen als een briljante oranje gele kleur.
Nitraatoplossingen (bijv. Nano3)
* De sleutelspeler: In nitraatoplossingen, zoals natriumnitraat (nano3), is de oranje gele kleur ook te wijten aan de natriumionen (Na+) . Het nitraation (NO3-) speelt geen belangrijke rol in de vlamkleur.
* Het mechanisme: Hetzelfde principe is van toepassing. De warmte boeit de natriumionen, waardoor ze licht uitzenden in het oranje-gele bereik.
Waarom het verwarrend is:
* Gemeenschappelijke ionen: Zowel natriumchloride als nitraatoplossingen bevatten natriumionen (Na+). Daarom produceren ze allebei dezelfde oranje gele kleur.
* verschillende anionen: De anionen in deze verbindingen (chloride (Cl-) in natriumchloride en nitraat (NO3-) in natriumnitraat) hebben echter verschillende eigenschappen en beïnvloeden de kleur van de vlam niet.
Key Takeaway:
Hoewel zowel natriumchloride- als nitraatoplossingen dezelfde oranje geelle vlam produceren, is dit alleen vanwege de aanwezigheid van natriumionen. Het is belangrijk om te begrijpen dat de kleur voortkomt uit de geëxciteerde elektronen van het specifieke element, niet de hele verbinding.
 Wat is het atoomnummer van de kern?
Wat is het atoomnummer van de kern?  Onderzoek onthulde de allereerste kristalstructuur van de dopamine 2-receptor gebonden aan een antipsychoticum
Onderzoek onthulde de allereerste kristalstructuur van de dopamine 2-receptor gebonden aan een antipsychoticum Hoe bepaal je het aantal atomen in enige hoeveelheid mol een atoom?
Hoe bepaal je het aantal atomen in enige hoeveelheid mol een atoom?  Wat is H2O -verbinding met behulp van het voorraadsysteem?
Wat is H2O -verbinding met behulp van het voorraadsysteem?  Hoeveel moleculen zijn er in 0,0710 mol NH3?
Hoeveel moleculen zijn er in 0,0710 mol NH3?
 Droogte maakt Californische reservoirs zo heet, droge zomer weefgetouwen
Droogte maakt Californische reservoirs zo heet, droge zomer weefgetouwen Hoe de Atlantische Oceaan onderdeel werd van de wereldwijde circulatie op een klimaatomslagpunt
Hoe de Atlantische Oceaan onderdeel werd van de wereldwijde circulatie op een klimaatomslagpunt Hoe de rijstproductie in India zich kan aanpassen aan de uitdagingen van de klimaatverandering
Hoe de rijstproductie in India zich kan aanpassen aan de uitdagingen van de klimaatverandering Papers onderzoeken enorme planktonbloei met zeer verschillende ecosysteemeffecten
Papers onderzoeken enorme planktonbloei met zeer verschillende ecosysteemeffecten Wat is de betekenis van niet-levende dingen?
Wat is de betekenis van niet-levende dingen?
Hoofdlijnen
- DNA-reparatie na CRISPR-snijden helemaal niet wat mensen dachten
- Hoe betrouwbaar zijn schildpadden voor het meten van afval in de oceaan en de gezondheid van de zee?
- Leg uit hoe een vorstzak ontstaat in de tuinbouw?
- Waar vinden transcriptie en vertaling plaats in de eukaryoten?
- Welke insecten dragen de malariaparasiet?
- Ideeën voor het maken van een 3-D DNA-standaard voor middelbare school
- Draagt transfer-RNA gecodeerde berichten over van de kern naar het cytoplasma?
- Wat is de inososfeer?
- Wat zijn de componenten van een staat?
- Nieuwe techniek waarbij medicijnen bacteriën laten gloeien, kan antibioticaresistentie helpen bestrijden
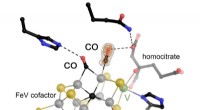
- Vanadiumafhankelijke stikstofase kan twee CO-moleculen tegelijk binden
- Als A.I. had een brein - ingenieurs modelleren een kunstmatige synaps naar het menselijk brein

- Targeting van viraal RNA:de basis voor de volgende generatie antivirale middelen met een breed spectrum
- Slimmer verwarmen, niet moeilijker:hoe microgolven katalytische reacties efficiënter maken

 Behoud van het regenwoud door machine learning
Behoud van het regenwoud door machine learning Welk ecosysteem heeft vruchtbare grond bedekt met hoog gras?
Welk ecosysteem heeft vruchtbare grond bedekt met hoog gras?  Studie vindt mensen massaal, of zich op dezelfde manier gedragen als anderen, ondanks redeneervermogen
Studie vindt mensen massaal, of zich op dezelfde manier gedragen als anderen, ondanks redeneervermogen Een sessiele druppel optillen van een superamfifoob oppervlak met behulp van een inslaande druppel
Een sessiele druppel optillen van een superamfifoob oppervlak met behulp van een inslaande druppel Wat zijn de vier planeten met banen van het meest naar de minste?
Wat zijn de vier planeten met banen van het meest naar de minste?  Wat betekent ohm in de natuurkunde?
Wat betekent ohm in de natuurkunde?  Is aardgas een goede energiebron?
Is aardgas een goede energiebron?  Leg een sterren van een schijnbare omvang en absolute omvang uit?
Leg een sterren van een schijnbare omvang en absolute omvang uit?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

