
Wetenschap
Is een metaal oplosbaar in water?
Dit is waarom:
* metalen bindingen: Metalen worden bij elkaar gehouden door sterke metalen bindingen, waarbij een "zee" van gedelokaliseerde elektronen betrokken is. Deze bindingen zijn erg moeilijk te breken.
* polariteit: Water is een polair molecuul, wat betekent dat het een positief en negatief einde heeft. De meeste metalen zijn niet polair, dus ze interageren niet goed met watermoleculen.
* Uitzonderingen: Er zijn enkele uitzonderingen op deze regel. Bijvoorbeeld:
* Alkali metalen (zoals natrium en kalium) reageren gewelddadig met water. Ze lossen niet op in de traditionele zin, maar ze reageren om waterstofgas en een metaalhydroxide te vormen.
* Sommige metaalionen kan worden opgelost in water. Kopersulfaat lost bijvoorbeeld op in water om koperionen (Cu2+) en sulfaationen (SO42-) te vormen.
Samenvattend: De meeste metalen zijn niet oplosbaar in water omdat hun sterke metalen bindingen en gebrek aan polariteit het voor hen moeilijk maken om te interageren met watermoleculen.
 Wat is een vloeibare brandstof afgeleid van plantaardige materialen?
Wat is een vloeibare brandstof afgeleid van plantaardige materialen?  Neutronenbundel van kernreactor gebruikt om veiligere auto's te produceren
Neutronenbundel van kernreactor gebruikt om veiligere auto's te produceren Staal- en messinglegeringen kunnen worden onderscheiden door?
Staal- en messinglegeringen kunnen worden onderscheiden door?  Hoeveel elektronen zijn er op elke baan voor natrium?
Hoeveel elektronen zijn er op elke baan voor natrium?  Afgedankt afval kan een schat aan zeldzame metalen zijn
Afgedankt afval kan een schat aan zeldzame metalen zijn
 Nieuwe methode voor het onderzoeken van poriegeometrie in gesteenten
Nieuwe methode voor het onderzoeken van poriegeometrie in gesteenten Toekomstige orkanen kunnen het vermogen van de bossen in New England om koolstof op te slaan en vast te leggen in gevaar brengen
Toekomstige orkanen kunnen het vermogen van de bossen in New England om koolstof op te slaan en vast te leggen in gevaar brengen  Graupel is geen sneeuw, noch natte sneeuw, geen hagel, dus wat is het in vredesnaam?
Graupel is geen sneeuw, noch natte sneeuw, geen hagel, dus wat is het in vredesnaam?  Kunstmatige 'snavels' die water uit mist opvangen:een oplossing voor droogte?
Kunstmatige 'snavels' die water uit mist opvangen:een oplossing voor droogte?  Het vuil op bodemverlies door de overstromingen in het Midwesten
Het vuil op bodemverlies door de overstromingen in het Midwesten
Hoofdlijnen
- Langdurige oceaanbemonstering in Narragansett Bay onthult dalende planktonniveaus:impact onzeker voor lokaal voedselweb
- Monniksparkieten vallen Mexico binnen
- Waarom kunnen de onderzoeken van Robert Hooke en Anton van Leeuwenhoek worden beschouwd als een begin van microscopiemicrobiologie?
- Wat is de hypothese die de beweging van vloeistof door floëem in een plant verklaart?
- Hoe eiwitten hun plaats in de cel vinden
- Hoe je eiwitten op de juiste snelheid produceert
- Wat is beweging in levende organismen?
- Wanneer een cel zich voorbereidt om zich te verdelen om zijn dochter alle informatie te hebben die hij moet overzien?
- 2 Integrale membraaneiwitten zoals transport worden permanent bevestigd aan cellulaire membranen na gesynthetiseerd welke organel zou helpen bij het transport?
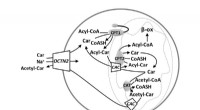
- OCTN:een transporter met relevantie voor menselijke pathofysiologie, ontdekking en diagnostiek van geneesmiddelen
- Watermoleculen splitsen voor een toekomst met hernieuwbare energie

- Nieuwe zilveren holle vezel verhoogt de elektroreductie van CO2
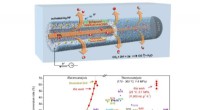
- Proces verwijdert tegelijkertijd giftige metalen en zout om schoon water te produceren

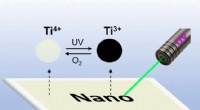
- Schrijven met licht op titanium:herschrijfbare UV-gevoelige oppervlakken gemaakt van gedoteerde TiO2-nanokristallen
 Wie heeft het Bernoulli -principe gemaakt en wanneer?
Wie heeft het Bernoulli -principe gemaakt en wanneer?  Hoe is het water bij Equator?
Hoe is het water bij Equator?  Hoeveel sterren vormen het sterrenbeeld Columba?
Hoeveel sterren vormen het sterrenbeeld Columba?  Wetenschappers leren hoe planten met meerdere genen zich voortplanten
Wetenschappers leren hoe planten met meerdere genen zich voortplanten  Wat creëert geluid van digitale instructies?
Wat creëert geluid van digitale instructies?  Wat is het punt waarop een planeet de grootste afstand van de zon in een baan op de aarde is?
Wat is het punt waarop een planeet de grootste afstand van de zon in een baan op de aarde is?  Beschadigt het gebruik van te veel elektriciteitsschade de ozonlaag?
Beschadigt het gebruik van te veel elektriciteitsschade de ozonlaag?  Wie heeft lineaire beweging ontdekt?
Wie heeft lineaire beweging ontdekt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

