
Wetenschap
Waarom ziet de verandering voor atomaire stralen van elementen in periode 3 van natrium tot argon er hetzelfde uit 2?
overeenkomsten:
* Afnemende atoomradius: Beide periodes vertonen een afname van de atomaire straal terwijl u van links naar rechts beweegt. Dit komt door de toenemende nucleaire lading (aantal protonen). De grotere aantrekkingskracht tussen de kern en de elektronen trekt de elektronen dichterbij en krimpt het atoom.
* elektronen toegevoegd aan hetzelfde energieniveau: In beide perioden worden de elektronen toegevoegd aan hetzelfde belangrijkste energieniveau (n =2 voor periode 2, n =3 voor periode 3). Dit betekent dat de elektronen zich over het algemeen op dezelfde afstand van de kern bevinden en bijdragen aan de totale trend van de grootte.
Verschillen:
* Afschermingseffect: In periode 3 biedt het verhoogde aantal binnenste schaal elektronen (elektronen in de n =1 en n =2 niveaus) meer afscherming van de kern voor de valentie -elektronen (elektronen in het n =3 niveau). Deze afscherming vermindert de effectieve nucleaire lading die wordt gevoeld door de valentie -elektronen, waardoor een iets grotere atoomradius in periode 3 wordt veroorzaakt dan in periode 2 voor overeenkomstige elementen.
* elektronenafstoting: In periode 3 leidt het verhoogde aantal elektronen in hetzelfde energieniveau tot grotere afstoting van elektronen-elektronen. Deze afstoting duwt de elektronen verder uit elkaar, waardoor het atoom iets groter is.
Samenvatting:
Hoewel de trend van afnemende atoomradius over periodes 2 en 3 vergelijkbaar is, resulteert de verhoogde afscherming en elektronenafstoting in periode 3 in iets grotere atoomstralen vergeleken met de overeenkomstige elementen in periode 2.
Key Takeaway: De periodieke trends in atomaire stralen worden aangedreven door een complex samenspel van factoren, waaronder nucleaire lading, afschermingseffect en afstoting van elektronen-elektronen. Deze factoren beïnvloeden de grootte van het atoom en creëren verschillende trends over periodes en down -groepen.
 Welke combinatie van metalen zou elektrolytische corrosie het meest uitgesproken zijn.
Welke combinatie van metalen zou elektrolytische corrosie het meest uitgesproken zijn.  Wat is de obligatieorder voor B2 plus?
Wat is de obligatieorder voor B2 plus?  Hoe ziet hydrocholinezuur eruit?
Hoe ziet hydrocholinezuur eruit?  Waarom frisdrank is een mengsel en waterverbinding?
Waarom frisdrank is een mengsel en waterverbinding?  Zonnecellen:het landschap van op cesium gebaseerde anorganische halide perovskieten in kaart brengen
Zonnecellen:het landschap van op cesium gebaseerde anorganische halide perovskieten in kaart brengen
 Zullen reeën blijven bestaan? Klimaatverandering is een ramp voor soorten die het tempo niet kunnen bijhouden
Zullen reeën blijven bestaan? Klimaatverandering is een ramp voor soorten die het tempo niet kunnen bijhouden  Op welke 2 manieren kunnen er elementen in de natuur plaatsvinden?
Op welke 2 manieren kunnen er elementen in de natuur plaatsvinden?  Onzekerheid rond schattingen van methaanuitstoot door vee in de VS
Onzekerheid rond schattingen van methaanuitstoot door vee in de VS Waarom de aarde nu een koerscorrectie nodig heeft
Waarom de aarde nu een koerscorrectie nodig heeft Hoe je de doelstellingen op het gebied van diversiteit van studenten kunt bereiken en tegelijkertijd ouders inspraak kunt geven in waar hun kind naar school gaat
Hoe je de doelstellingen op het gebied van diversiteit van studenten kunt bereiken en tegelijkertijd ouders inspraak kunt geven in waar hun kind naar school gaat
Hoofdlijnen
- Wat bedoel je met de cerebrum regelt je hersenen?
- Waar kan cirkelvormig DNA worden gevonden bij dieren?
- Zou de ontdekking van een sleutelgensysteem de laatste zucht van koralen kunnen verstikken?
- Olifantenstroperij in Afrika neemt af, maar ivoorvangsten nemen toe:studie
- Hoe begrijpen wetenschappers gegevens?
- Wat bevordert de opslag van glucose als glycogeen?
- Wetenschappers classificeren dieren door gedeeld wat?
- Nieuw onderzoek laat zien hoe ziekteverwekkende parasieten de menselijke aangeboren immuniteit omzeilen
- Wat is een organel in een cel?
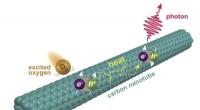
- Chemici krijgen een kijkje in nieuwe fluorescentie in koolstofnanobuisjes
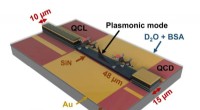
- Geminiaturiseerde lab-on-a-chip voor realtime chemische analyse van vloeistoffen
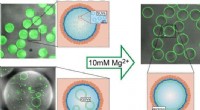
- Celachtige lipideblaasjes die kunnen worden gevuld met natuurlijke celeiwitten
- Met trucs voor materiaalverwerking kunnen ingenieurs nieuw lasermateriaal maken

- Verbeteren van de samenstelling van stralingsbeschermingsbrillen

 Hoe zijn zowel geluid als lichte energie?
Hoe zijn zowel geluid als lichte energie?  Temperaturen in de Savannah Grasland
Temperaturen in de Savannah Grasland Wat gebeurt er wanneer u baking soda met azijn mengt om een ballon op te blazen?
Wat gebeurt er wanneer u baking soda met azijn mengt om een ballon op te blazen?  Wat is de energie van een foton dat lichtfrequentie uitzendt 4.47 x 10 14 Hz?
Wat is de energie van een foton dat lichtfrequentie uitzendt 4.47 x 10 14 Hz?  Wanneer wordt de kinetische energie overgedragen van object naar object?
Wanneer wordt de kinetische energie overgedragen van object naar object?  Wat is de formule voor ammoniumsulfide als een neutrale verbinding?
Wat is de formule voor ammoniumsulfide als een neutrale verbinding?  Wat zijn de drie soorten modellen die in de wetenschap worden gebruikt?
Wat zijn de drie soorten modellen die in de wetenschap worden gebruikt?  Nieuw proces stimuleert lignine bio-olie als brandstof van de volgende generatie
Nieuw proces stimuleert lignine bio-olie als brandstof van de volgende generatie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

