
Wetenschap
Corrodet koper of ijzeren sneller en waarom?
* Elektrochemische reacties: Corrosie is een elektrochemisch proces. Metalen reageren met hun omgeving, verliezen elektronen en het vormen van oxiden. Dit proces wordt beïnvloed door factoren zoals:
* Elektrochemische potentiaal: IJzer heeft een meer negatieve elektrochemisch potentieel dan koper. Dit betekent dat het meer kans heeft om elektronen te verliezen en te corroderen.
* Aanwezigheid van zuurstof en water: Zowel ijzer als koperen corrode in aanwezigheid van zuurstof en water. IJzer reageert echter gemakkelijker met deze elementen.
* Vorming van oxiden:
* ijzeroxide (roest): IJzer vormt een losse, poreuze oxidelaag genaamd roest. Roest is niet beschermend en zorgt ervoor dat verdere corrosie kan optreden.
* Koperoxide: Koper vormt een strakke, beschermende oxidelaag genaamd Patina. Patina fungeert als een barrière en vertraagt verdere corrosie.
* Omgevingsfactoren:
* zuurgraad: IJzer corrodeert sneller in zure omgevingen.
* zoutgehalte: Zoutwater versnelt corrosie in zowel ijzer als koper, maar ijzer is gevoeliger.
Samenvattend: Het lagere elektrochemische potentieel van ijzer, de poreuze aard van de oxidelaag en de grotere reactiviteit ervan met zuurstof en water dragen allemaal bij aan de snellere corrosiesnelheid in vergelijking met koper.
 Welke term verwijst naar de beweging van moleculen uit een hogere concentratie een gebied lagere concentratie?
Welke term verwijst naar de beweging van moleculen uit een hogere concentratie een gebied lagere concentratie?  Chemicus die elektrische velden bestudeert, microfluïdica om de dialysetechnologie te verbeteren
Chemicus die elektrische velden bestudeert, microfluïdica om de dialysetechnologie te verbeteren Hoeveel procent van de gassen ademt u in?
Hoeveel procent van de gassen ademt u in?  Wat beïnvloedt zowel de oplossingssnelheid als de oplosbaarheid van een vaste stof in vloeistof?
Wat beïnvloedt zowel de oplossingssnelheid als de oplosbaarheid van een vaste stof in vloeistof?  Welke andere methode om een vloeistof van een vaste stof te scheiden heb je vandaag geleerd dan filtratie?
Welke andere methode om een vloeistof van een vaste stof te scheiden heb je vandaag geleerd dan filtratie?
 De ongerepte stranden van Australië hebben een poepprobleem
De ongerepte stranden van Australië hebben een poepprobleem Verbetering van voorspellingen van hittegolven op zee met geavanceerde assimilatie van oceaangegevens
Verbetering van voorspellingen van hittegolven op zee met geavanceerde assimilatie van oceaangegevens  Gestrande activa kunnen hoge kosten met zich meebrengen voor producenten en investeerders van fossiele energie
Gestrande activa kunnen hoge kosten met zich meebrengen voor producenten en investeerders van fossiele energie EPA-adviseur promoot schadelijke ideeën, wetenschappers zeggen:
EPA-adviseur promoot schadelijke ideeën, wetenschappers zeggen: Onderzoekers observeren hoe Canadese en Californische regenboogforellen reageren op hogere temperaturen
Onderzoekers observeren hoe Canadese en Californische regenboogforellen reageren op hogere temperaturen
Hoofdlijnen
- Wat maakt mensen menselijk?
- Ongebreidelde bosbranden hebben ooit geleid tot wereldwijde massale uitsterving, zeggen wetenschappers. Kan het nog een keer gebeuren?
- Wat is de definitie van merk -DNA?
- Wat is het ruwe endoplasmatisch reticulum?
- Wat is de belangrijkste bijdrage van wetenschapper?
- Organismen die groeien op plantaardige materialen en voedsel absorberen zijn?
- Kan biochar helpen broeikasgassen te onderdrukken?
- Wat hebben de dochter- en oudercel gemeen?
- Welke is een masterklier bij mensen?
- Onderzoekers ontwikkelen een koolstofveer met hoge samendrukbaarheid en rekbaarheid

- Video:Wordt het kombucha?

- Flexibele circuits afstemmen met licht
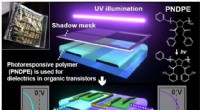
- Flesvoeding meer op menselijke moedermelk maken

- Het doorbreken van de mal:een ongebruikelijke materiaalkeuze levert batterijen met een ongelooflijk lange levensduur op

 Hoe is een zachte bries uit het westen?
Hoe is een zachte bries uit het westen?  Wat betekent recessief wat betreft genen?
Wat betekent recessief wat betreft genen?  Welke uitzonderingen zijn er in de toename van ionisatie-energieën over een bepaalde periode?
Welke uitzonderingen zijn er in de toename van ionisatie-energieën over een bepaalde periode?  Wat zijn 3 materialen in de omgeving die licht buigen?
Wat zijn 3 materialen in de omgeving die licht buigen?  Is een machine -apparaat dat energie creëert?
Is een machine -apparaat dat energie creëert?  Onderwater telecomkabels maken een prachtig seismisch netwerk
Onderwater telecomkabels maken een prachtig seismisch netwerk Hoe classificeer je het verschil tussen een fysische en chemische verandering?
Hoe classificeer je het verschil tussen een fysische en chemische verandering?  Kooldioxide als grondstof
Kooldioxide als grondstof
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

