
Wetenschap
Waarom vormt BCL3 geen dubbele binding met één chlooratoom en enkele andere twee atomen?
1. BORON'S ELEKTRON -configuratie: Boron heeft slechts drie valentie -elektronen. Om een dubbele binding te vormen, zou het vier elektronen in zijn buitenste schaal nodig hebben. Dit is niet mogelijk met de elektronische structuur van Boron.
2. Octetregel: Boron in BCL3 heeft slechts zes elektronen eromheen, wat minder is dan de octetregel vereist voor stabiliteit. Een dubbele binding zou boor 10 elektronen geven, die de octetregel overschrijdt.
3. Backbonding: Hoewel Boron theoretisch een dubbele binding kan vormen, is het niet energetisch gunstig. De dubbele binding zou een backdonering van elektronendichtheid van een chloorbeeld inhouden naar de boor -lege p -orbital. Deze backbonding is zwak en draagt niet significant bij aan de stabiliteit van het molecuul.
4. Bondlengtes en hoeken: De waargenomen bindingslengtes en hoeken in BCL3 zijn consistent met enkele bindingen. De B-CL-bindingslengte is langer dan verwacht voor een dubbele binding, en de bindingshoeken liggen bijna 120 graden, wat een trigonale vlakke geometrie aangeeft.
5. Experimenteel bewijs: BCL3 is een bekende stabiele verbinding en de eigenschappen zijn consistent met een trigonale vlakke geometrie met drie enkele bindingen. Geen bewijs ondersteunt het bestaan van een dubbele binding.
Samenvattend vormt BCL3 geen dubbele binding vanwege de beperkte valentie -elektronen van Boron, de octetregel, de zwakte van backbonding en het experimentele bewijs dat enkele bindingen ondersteunt.
 Wat betekent "Geografische locatie"?
Wat betekent "Geografische locatie"?  Wat voor soort wetenschapper bestudeert de relatie tussen levende wezens en natte grasachtige gebieden zoals moerassen?
Wat voor soort wetenschapper bestudeert de relatie tussen levende wezens en natte grasachtige gebieden zoals moerassen?  Waarom zou een wetenschapper rotsformaties en levende organismen in voorheen onontgonnen waterhabitats willen bestuderen?
Waarom zou een wetenschapper rotsformaties en levende organismen in voorheen onontgonnen waterhabitats willen bestuderen?  Planetaire botsing die de maan vormde, maakte het leven op aarde mogelijk
Planetaire botsing die de maan vormde, maakte het leven op aarde mogelijk De onbedoelde gevolgen van dammen en reservoirs
De onbedoelde gevolgen van dammen en reservoirs
Hoofdlijnen
- Precies weten wat genen zeggen – en waar
- Hebben plantencellen een celwand in plaats van membraan?
- Oogenese produceert uiteindelijk hoeveel cellen?
- Lantaarnvissen onthullen hoe de opwarming van de oceaan de schemerzone beïnvloedt
- Schedels die wild zijn geworden:hoe en waarom sommige kikkers extreme hoofden ontwikkelden
- Een opkomend tij van zeeziekten? Hoe parasieten reageren op een opwarmende wereld
- Glycolyse: definitie, stappen, producten en reactanten
- Wat is het koekjessnijder Shark Biome?
- Kan de elektronenmicroscoop worden gebruikt om een levend monster te bestuderen en waarom?
- Goedkoop, schaalbare watersplitsing voedt de toekomstige waterstofeconomie

- Informatiefilter voor immuunafweer
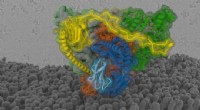
- Moleculair mechanisme van door rutheniumcomplex geïnduceerde DNA-fasescheiding onthuld
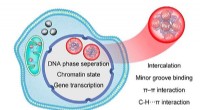
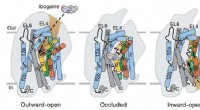
- Verslaving behandelen:Cryo-EM-technologie maakt het onmogelijke mogelijk
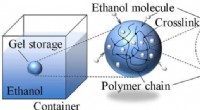
- Wetenschappers laten zien hoe vloeibare brandstoffen in polymere gels kunnen worden opgeslagen om explosies en branden te voorkomen
 Als een massa graniet in contact staat met laagzandsteen die kleine stukjes bevat, welke rots ouder?
Als een massa graniet in contact staat met laagzandsteen die kleine stukjes bevat, welke rots ouder?  Studie onthult nieuw inzicht in onsterfelijke plantencellen
Studie onthult nieuw inzicht in onsterfelijke plantencellen Conceptueel model legt uit hoe onweerswolken samenkomen
Conceptueel model legt uit hoe onweerswolken samenkomen Hoe gemakkelijk ontbrandt Bio -ethanol?
Hoe gemakkelijk ontbrandt Bio -ethanol?  De tak van de wetenschap die zich bezighoudt met wetenschappelijke studiebodem?
De tak van de wetenschap die zich bezighoudt met wetenschappelijke studiebodem?  Wat zijn enkele items die elektromagneten gebruiken?
Wat zijn enkele items die elektromagneten gebruiken?  NASA vindt enkele sterke stormen in de Atlantische Oceaan, potentiële tropische cycloon
NASA vindt enkele sterke stormen in de Atlantische Oceaan, potentiële tropische cycloon Wat voor soort objecten zouden de grootste krachtpanaat ervaren?
Wat voor soort objecten zouden de grootste krachtpanaat ervaren?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

