
Wetenschap
Welke massa fluorgas is nodig om volledig te reageren met 17,8 g zwavelvorm hexafluoride?
1. Schrijf de gebalanceerde chemische vergelijking:
S (s) + 3f₂ (g) → sf₆ (g)
2. Converteer gram zwavel in mol:
* Molaire massa van zwavel (s) =32,06 g/mol
* Mol S =(17,8 g) / (32,06 g / mol) =0,555 mol
3. Gebruik de molverhouding van de gebalanceerde vergelijking om mol fluor te vinden:
* Uit de vergelijking reageert 1 mol zwavel met 3 mol fluor.
* Mol f₂ =(0,555 mol s) * (3 mol f₂ / 1 mol s) =1.665 mol f₂
4. Zet mol fluor om in gram:
* Molaire fluormassa (f₂) =38,00 g/mol
* Massa van f₂ =(1.665 mol f₂) * (38,00 g/mol) = 63.27 g
Daarom is 63,27 g fluorgas nodig om volledig te reageren met 17,8 g zwavel om zwavel hexafluoride te vormen.
 Afbreekbare elektronische componenten gemaakt van maïszetmeel
Afbreekbare elektronische componenten gemaakt van maïszetmeel Wat is de binaire verbinding van kalium en stikstof?
Wat is de binaire verbinding van kalium en stikstof?  Wetenschappers vinden groene schat - zij het roestig - in de bodem
Wetenschappers vinden groene schat - zij het roestig - in de bodem Nieuwe technologie identificeert consequent eiwitten uit een dozijn cellen
Nieuwe technologie identificeert consequent eiwitten uit een dozijn cellen Een stof die geen hydroxide -ionen in een wateroplossing vormt, is basis?
Een stof die geen hydroxide -ionen in een wateroplossing vormt, is basis?
 Wat kunnen verwering en erosie doen voor landvormen?
Wat kunnen verwering en erosie doen voor landvormen?  Hoe heet de wetenschap of kunst van het gebouw?
Hoe heet de wetenschap of kunst van het gebouw?  Hoe relevant wetenschap en technologie die relevant zijn voor je leven?
Hoe relevant wetenschap en technologie die relevant zijn voor je leven?  Arctische permafrost bevat mogelijk slapende reus van de koolstofemissies ter wereld
Arctische permafrost bevat mogelijk slapende reus van de koolstofemissies ter wereld Waarom planten pollen en sporen nodig hebben?
Waarom planten pollen en sporen nodig hebben?
Hoofdlijnen
- Welke medicijnen bestrijden microben?
- Onderzoek werpt nieuw licht op de soortoverschrijdende virusoverloop die pandemieën kan veroorzaken
- Biologen ontdekken hoe algen fosfor opnemen na gedwongen verhongering
- Alternatieve versies van genen worden genoemd?
- Waarom moet gedrag een genetische component hebben om te worden begunstigd door natuurlijke selectie?
- Waarom groeit algen snel met kunstmest?
- Hoeveel bijen passen er in een röntgenapparaat? Onderzoekers kijken in zwermen om hun verspreiding dieper te bekijken
- In het blauw:hoe baleinwalvissen zich de afgelopen 50 miljoen jaar hebben aangepast
- Migratie loont voor zangvogels
- Verbetering van de prestaties van een thermo-elektrisch materiaal door selectieve atomen gedeeltelijk te vervangen door kationen

- Hoe werkt vuurwerk? Een pyrotechnisch scheikundige legt de wetenschap uit achter de schitterende kleuren en geluiden

- Uitvinding van vormveranderend textiel dat alleen wordt aangedreven door lichaamswarmte
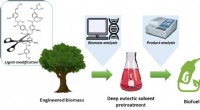
- Team ontwikkelt productieproces voor biobrandstof in samenwerking met Noord-Amerikaanse onderzoekers
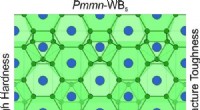
- Wetenschappers voorspellen een nieuw superhard materiaal met unieke eigenschappen
 Wat is de vergelijking voor hydrofluorinezuur en natriumhydroxide?
Wat is de vergelijking voor hydrofluorinezuur en natriumhydroxide?  Nieuwe technologie voor machinevertaling nu beschikbaar
Nieuwe technologie voor machinevertaling nu beschikbaar Wat zijn twee bewijsstukken voor continentale drift?
Wat zijn twee bewijsstukken voor continentale drift?  Hoe kun je weten dat er een kracht bestaat als je hem ziet?
Hoe kun je weten dat er een kracht bestaat als je hem ziet?  Wat geldt voor wolken?
Wat geldt voor wolken?  Antarctisch Schiereiland op warmste in decennia:studie
Antarctisch Schiereiland op warmste in decennia:studie Welk percentage sterren bevindt zich in meerdere sterrensystemen?
Welk percentage sterren bevindt zich in meerdere sterrensystemen?  Welke planten groeien in een ravijn?
Welke planten groeien in een ravijn?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

