
Wetenschap
Hoe worden overgangsmetalen genoemd in metaalverbindingen?
1. Romeinse cijfers:
* variabele ladingen: Overgangsmetalen hebben vaak meerdere mogelijke ladingen (oxidatietoestanden). Om te verduidelijken welke lading aanwezig is, gebruiken we Romeinse cijfers tussen haakjes na de metalen naam.
* Voorbeeld:
* fecl2: IJzer (ii) chloride (Fe heeft een +2 lading)
* fecl3: IJzer (III) chloride (Fe heeft een +3 lading)
2. Uitzonderingen op Romeinse cijfers:
* Vaste kosten: Sommige overgangsmetalen * hebben altijd * dezelfde lading in hun verbindingen. Deze vereisen geen Romeinse cijfers.
* Gemeenschappelijke voorbeelden:
* Ag: Zilver (altijd +1)
* Zn: Zink (altijd +2)
* CD: Cadmium (altijd +2)
3. Latijnse namen:
* Historisch gebruik: Voor sommige metalen gebruiken we hun Latijnse namen in de samengestelde naam, met name voor overgangsmetalen met gemeenschappelijke ladingen.
* Voorbeelden:
* CUCL: Koper (I) chloride of koperchloride
* CUCL2: Koper (ii) chloride of cupric chloride
* Feo: IJzer (ii) oxide of ijzeroxide
* fe2O3: IJzer (iii) oxide of ijzeroxide
4. Anionen noemen:
* niet-metalen: Gebruik voor niet-metale anionen de wortel van de naam en voeg "-ide" toe.
* Cl-: Chloride
* o2-: Oxyde
* S2-: Sulfide
* Polyatomische ionen: Deze hebben specifieke namen die u moet onthouden.
* No3-: Nitraat
* SO42-: Sulfaat
* po43-: Fosfaat
Voorbeeld:
Laten we zeggen dat we de compound hebben cocl3 . Hier is hoe je het kunt noemen:
* co: Kobalt (overgangsmetaal met variabele lading)
* Cl: Chloor (niet-metaal, vormt chloride)
* Bepaal de lading van CO: Omdat chloride een -1 lading heeft en er drie chloriden zijn, is de totale negatieve lading -3. Om dit in evenwicht te brengen, moet Cobalt een +3 lading hebben.
* Eindnaam: Kobalt (iii) chloride
Onthoud: Oefening maakt perfect. Met voldoende blootstelling aan het benoemen van verbindingen, begin je gemeenschappelijke patronen te herkennen en de namen te onthouden!
 Welke materialen heb je nodig om te vinden welk type water bevat de minste hoeveelheid chloor?
Welke materialen heb je nodig om te vinden welk type water bevat de minste hoeveelheid chloor?  Wat zijn ijzerertsklonten en boetes. het verschil?
Wat zijn ijzerertsklonten en boetes. het verschil?  Waarom is lucht een mengsel?
Waarom is lucht een mengsel?  Wanneer de CO2 -concentratie in cellen van een C3 -plant laag is in vergelijking met O2, combineert een enzym RUBP in plaats van welk effect zou dit hebben op fotosynthese?
Wanneer de CO2 -concentratie in cellen van een C3 -plant laag is in vergelijking met O2, combineert een enzym RUBP in plaats van welk effect zou dit hebben op fotosynthese?  Hoe producten in chemische reacties te voorspellen
Hoe producten in chemische reacties te voorspellen
 Duurzaamheid definiëren en meten
Duurzaamheid definiëren en meten Waarom de overstap van foerageren naar landbouw?
Waarom de overstap van foerageren naar landbouw?  Vulkaanuitbarstingen op hoge breedte hebben wereldwijde impact
Vulkaanuitbarstingen op hoge breedte hebben wereldwijde impact Welke instrumenten kunnen worden gebruikt om een overstroming te voorspellen?
Welke instrumenten kunnen worden gebruikt om een overstroming te voorspellen?
Dankzij weersvoorspellingstechnologie konden meteorologen mensen voorzien van kortetermijnvoorspellingen. Helaas betekent het simpelweg voorspellen van een onweersbui n
 Grote gegevens, kunstmatige intelligentie ter ondersteuning van onderzoek naar schadelijke blauwalgen
Grote gegevens, kunstmatige intelligentie ter ondersteuning van onderzoek naar schadelijke blauwalgen
Hoofdlijnen
- Welke term definieert een gen dat bestaat uit twee verschillende allelen?
- Wat is de belangrijkste rol van eierstokken en testikels bij de mens?
- De genetische basis en het proces van inteeltdepressie bij een elite hybride rijst
- Wat gebeurt er als te veel schadelijke bacteriën het systeem binnenkomen?
- Wat is een verschil tussen Desmides en diatomeeën?
- Wat gebeurt er met de nucleaire envelop tijdens cytokinese?
Cytokinese is de verdeling van één cel in twee en is de laatste stap na de mitotische celcyclus in vier stadia. Tijdens cytokinese blijft de nucleaire envelop, of kernmembraan, die het gen
- Wat is de wetenschappelijke naam of taxonomische classificatie van giftige planten Amaryllis?
- Hoe voeden schimmels?
- Wat zijn de drie belangrijkste functies van sensorische informatie?
- Onderzoek beschrijft hoe ionen een sleutelrol spelen bij het beheersen van slijmvliesoppervlakken
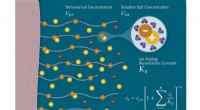
- Hoe kunstmatige nanofabrieken te bouwen om onze toekomst van energie te voorzien?

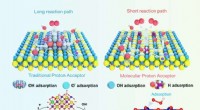
- Ontwerpstrategie op moleculair niveau kan de sleutel zijn tot het stimuleren van commerciële waterstofproductie
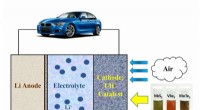
- Met 2D-materialen kunnen elektrische voertuigen 500 mijl afleggen op één lading
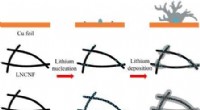
- Een lichtgewicht op koolstof nanovezel gebaseerde collector
 Structuur 6e millennium voor Christus ontdekt in Saoedi-Arabië
Structuur 6e millennium voor Christus ontdekt in Saoedi-Arabië Welk zeebioom wordt gekenmerkt door diepe waterdiepten die nooit zonlicht ontvangen?
Welk zeebioom wordt gekenmerkt door diepe waterdiepten die nooit zonlicht ontvangen?  Om te rechtvaardigen met de berekening is de gemiddelde snelheid gelijk aan onmiddellijke snelheid?
Om te rechtvaardigen met de berekening is de gemiddelde snelheid gelijk aan onmiddellijke snelheid?  Hoe de eerste wet kan worden afgeleid van de tweede wet?
Hoe de eerste wet kan worden afgeleid van de tweede wet?  Chloor (Cl) kan worden gevonden als een ion met een 1-lading. Hoe gebeurt dit?
Chloor (Cl) kan worden gevonden als een ion met een 1-lading. Hoe gebeurt dit?  Verhoogt de potentiële energie van een geladen batterij?
Verhoogt de potentiële energie van een geladen batterij?  Amazon voegt nog eens 3 toe, 000 banen in Canada
Amazon voegt nog eens 3 toe, 000 banen in Canada Wat is de straal van een galactisch cluster?
Wat is de straal van een galactisch cluster?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

