
Wetenschap
Wat is de moleculaire geometrie van O2F2 of diflouride -oxide?
* Lewis -structuur: Het centrale zuurstofatoom heeft twee enkele bindingen aan de fluoratomen en twee eenzame paren elektronen.
* vSEPR -theorie: De theorie van VSEPR (valentie shell elektronparen) voorspelt dat elektronenparen (zowel binding als niet-bindend) zich zullen regelen om afstoting te minimaliseren. In O₂f₂ zijn de vier elektronenparen rond het centrale zuurstofatoom gerangschikt in een tetraëdrische vorm.
* Moleculaire geometrie: De enige paren op het zuurstofatoom oefenen een sterkere afstoting uit dan de bindingsparen, waardoor de fluoratomen dichter bij elkaar worden geduwd. Dit resulteert in een gebogen of hoekige moleculaire geometrie.
Samenvattend: O₂f₂ heeft een geometrie van tetraëdrische elektronenparen, maar de moleculaire geometrie is gebogen vanwege de invloed van de enige paren op het centrale zuurstofatoom.
 Waarom is het symbool voor element zwavel anders dan de formule A -molecule zwavel?
Waarom is het symbool voor element zwavel anders dan de formule A -molecule zwavel?  Wat wordt waargenomen bij verhitting van zinknitraatzout?
Wat wordt waargenomen bij verhitting van zinknitraatzout?  Ozon breekt THC af dat is afgezet op oppervlakken van derdehands cannabisrook
Ozon breekt THC af dat is afgezet op oppervlakken van derdehands cannabisrook Is natriumchloraat ionisch of covalent?
Is natriumchloraat ionisch of covalent?  Bewegen de moleculen van elkaar af wanneer een gas of vloeistof weg is?
Bewegen de moleculen van elkaar af wanneer een gas of vloeistof weg is?
 Hoe telt Idaho wolven? Critici zeggen dat de staat ‘rook en spiegels’ gebruikt en het publiek misleidt
Hoe telt Idaho wolven? Critici zeggen dat de staat ‘rook en spiegels’ gebruikt en het publiek misleidt  Waarom vallen kruimels op aarde op de grond?
Waarom vallen kruimels op aarde op de grond?  Onderzoekers onderzoeken de perceptie van klimaatverandering bij producenten van speciale gewassen
Onderzoekers onderzoeken de perceptie van klimaatverandering bij producenten van speciale gewassen Bijen? Alsjeblieft. Deze planten zetten mieren aan het werk
Bijen? Alsjeblieft. Deze planten zetten mieren aan het werk  Hoe observeren wetenschappers het binnenlandse interieur?
Hoe observeren wetenschappers het binnenlandse interieur?
Hoofdlijnen
- Wat is het belangrijkste monosacharide?
- Hoe een organisme zijn interne lichaamsomstandigheden behoudt, zoals temperatuur en hoeveelheid watervoedingsstoffen?
- Wat is dat een goede wetenschapper?
- In welk type celdeling vermindert het chromosoomnummer met de ene helft en de gametenvorm?
- Wat voor soort wetenschapper bestudeert seks?
- Wat is de functie van DNA in jouw lichaam?
- Schimmelmicroben als biomeststoffen in landbouw en tuinieren:is de beloning groter dan het risico?
- Hoe een replicatieoorsprong te maken in meercellige eukaryoten
- Wat is Fredderick Griffith -hypothese?
- Nieuwe fotokatalysator zet koolstofdioxide effectief om in methaanbrandstof met licht

- Nanokatalysator maakt zwaar werk van mierenzuur
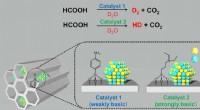
- Nieuwe biochemische verbinding kan milieuverontreinigende stoffen afbreken

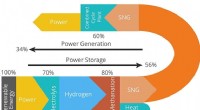
- Methaan kansrijke route voor opslag duurzame energie uit zon en wind
- Wetenschappers ontwerpen veelbelovende nieuwe kathode voor op natrium gebaseerde batterijen

 Wat zijn de kenmerken van blad- en uiencellen van wangcellen?
Wat zijn de kenmerken van blad- en uiencellen van wangcellen?  Biologen ontdekken hoe virussen de machinerie van cellen kapen
Biologen ontdekken hoe virussen de machinerie van cellen kapen  Wiskunde gaat over verwondering, creativiteit en plezier, dus laten we het zo leren
Wiskunde gaat over verwondering, creativiteit en plezier, dus laten we het zo leren Hoe heeft de weersomstandigheden het milieu in Plateaus Ecoregion beïnvloed?
Hoe heeft de weersomstandigheden het milieu in Plateaus Ecoregion beïnvloed?  Hoeveel mol natriumhydroxide is nodig om 0,20 mol salpeterzuur te neutraliseren?
Hoeveel mol natriumhydroxide is nodig om 0,20 mol salpeterzuur te neutraliseren?  Wat zit er achter een nummer 1-positie? Open-source LineUp-software maakt gedetailleerde analyse van subjectieve classificatiesystemen mogelijk
Wat zit er achter een nummer 1-positie? Open-source LineUp-software maakt gedetailleerde analyse van subjectieve classificatiesystemen mogelijk  SoftBank bevestigt deal om Flipkart-belang te verkopen aan Walmart
SoftBank bevestigt deal om Flipkart-belang te verkopen aan Walmart Wanneer de versnelling van een object negatief is?
Wanneer de versnelling van een object negatief is?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

