
Wetenschap
Kalium Een metaal met één elektron in de buitenste schaal zal reageren hoeveel chlooratomen?
Kalium (k) zal reageren met één Chlooratoom (CL). Dit is waarom:
* kalium (k): Het heeft één elektron in zijn buitenste schaal, waardoor het zeer reactief is. Het wil dit elektron verliezen om een stabiele elektronenconfiguratie te bereiken.
* chloor (CL): Het heeft zeven elektronen in zijn buitenste schaal. Het wil één elektron krijgen om een stabiele configuratie te bereiken.
Wanneer kalium en chloor reageren, verliest kalium * * het buitenste elektron en chloor * wint * dat elektron. Dit vormt een stabiele ionische binding, wat resulteert in het samengestelde kaliumchloride (KCL).
 Gepulseerde elektronenbundels werpen licht op de productie van kunststoffen
Gepulseerde elektronenbundels werpen licht op de productie van kunststoffen Wat zijn de overeenkomsten tussen NaCl en CACL2?
Wat zijn de overeenkomsten tussen NaCl en CACL2?  Wat zijn de vergelijkingen van hexaanbenzeen en acetyleen in test?
Wat zijn de vergelijkingen van hexaanbenzeen en acetyleen in test?  Efficiënter omgaan met grondstoffen met behulp van moleculaire transportbanden
Efficiënter omgaan met grondstoffen met behulp van moleculaire transportbanden Hoeveel elektronen heeft fluor op zijn uiterlijke schaal?
Hoeveel elektronen heeft fluor op zijn uiterlijke schaal?
 Adidas zet in op gerecycled materiaal om oceaanplastic te bestrijden
Adidas zet in op gerecycled materiaal om oceaanplastic te bestrijden Loodhoudend water:hoe huizen te houden, scholen, kinderdagverblijven en werkplekken veilig
Loodhoudend water:hoe huizen te houden, scholen, kinderdagverblijven en werkplekken veilig Langetermijnmetingen laten zien hoe het klimaat verandert
Langetermijnmetingen laten zien hoe het klimaat verandert  Is water een biotische factor in een omgeving?
Is water een biotische factor in een omgeving?  NASA ziet Karen de status van tropische storm terugkrijgen
NASA ziet Karen de status van tropische storm terugkrijgen
Hoofdlijnen
- Onderzoek laat zien hoe cellen grote genen verwerken
- "Fingerprint Experiments
- Hoe heet het geslacht voor een kruidnagel?
- Hoe het bewustzijn bij dieren onderzocht zou kunnen worden
- Nu weten we waarom wortels oranje zijn
- Het gebruik van glowsticks in vallen verhoogt de vangst van amfibieën in studie aanzienlijk
- Wat zijn enkele wetenschapsapparatuur?
- Hoe biofilms werken
- Virussen kennis ontsloten door nieuwe metagenomics-technologieën
- Onderzoekers ontwerpen katalysatoren voor dinucleaire locaties en onthullen het onderliggende mechanisme
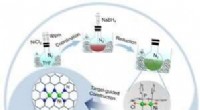
- Studie onthult de rol van platina bij de conversie van schone brandstof
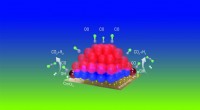
- Jodidezouten stabiliseren biokatalysatoren voor brandstofcellen

- Onderzoek effent de weg voor de volgende generatie kristallijne materiaalzeefapparatuur

- De inkt van de toekomst in gedrukte elektronica

 Isobutane smeltpunt en kookpunt?
Isobutane smeltpunt en kookpunt?  Heeft Mercurius satellieten of ringen?
Heeft Mercurius satellieten of ringen?  Is een fornuis een isolator of geleider?
Is een fornuis een isolator of geleider?  Ingenieurs creëren lichtgevende installaties die herhaaldelijk kunnen worden opgeladen
Ingenieurs creëren lichtgevende installaties die herhaaldelijk kunnen worden opgeladen Welke invloed op de beschikbaarheid van banen in de mariene biologie?
Welke invloed op de beschikbaarheid van banen in de mariene biologie?  Wat gebeurt er met de gemiddelde kinetische energie van materie wanneer deze wordt verwarmd?
Wat gebeurt er met de gemiddelde kinetische energie van materie wanneer deze wordt verwarmd?  Onderzoekers creëren een applicatie die anonimiteit en betrouwbaarheid garandeert
Onderzoekers creëren een applicatie die anonimiteit en betrouwbaarheid garandeert Wanneer de muren van de Grand Canyon Sandstone lagen worden opgemaakt, snijdt een dijk in een paar wanneer gevormd?
Wanneer de muren van de Grand Canyon Sandstone lagen worden opgemaakt, snijdt een dijk in een paar wanneer gevormd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

