
Wetenschap
Balans chemische vergelijking van natriumchloride plus kaliumjodide?
* Oplosbaarheid: Zowel natriumchloride (NaCl) als kaliumjodide (ki) zijn zeer oplosbaar in water. Dit betekent dat ze gemakkelijk oplossen in hun ionen (Na+, Cl-, K+en I-) in oplossing.
* Geen drijvende kracht: Er is geen sterke drijvende kracht voor de reactie. De producten die zich zouden vormen, natriumjodide (NAI) en kaliumchloride (KCL), zijn ook zeer oplosbaar en zouden gewoon in oplossing blijven als ionen.
Daarom zou de "chemische vergelijking" voor de reactie er zo uitzien:
NaCl (aq) + ki (aq) → Na + (aq) + cl- (aq) + k + (aq) + i- (aq)
In wezen gebeurt de reactie niet echt. De ionen bestaan gewoon samen in oplossing.
Laat het me weten als je andere chemische reacties wilt verkennen!
 Porcupinefish inspireert stevig superhydrofoob materiaal
Porcupinefish inspireert stevig superhydrofoob materiaal Wat is de inhoud van een reactiepapier?
Wat is de inhoud van een reactiepapier?  Zelfassemblerende homo-oligomeren van cyclische eiwitten
Zelfassemblerende homo-oligomeren van cyclische eiwitten Wat is de chemische formule voor natriumthiosulfaat en water?
Wat is de chemische formule voor natriumthiosulfaat en water?  Vochtbestendig haarstylingmiddel:ontwikkeling van een door vocht geïnduceerd polymeer materiaal met vormgeheugen
Vochtbestendig haarstylingmiddel:ontwikkeling van een door vocht geïnduceerd polymeer materiaal met vormgeheugen
 Hoe de man van de vrouw te onderscheiden Crickets
Hoe de man van de vrouw te onderscheiden Crickets Groene en eetbare huishoudfolie en voedselverpakkingen gemaakt van planten
Groene en eetbare huishoudfolie en voedselverpakkingen gemaakt van planten Voor welk proces, massaverspilling, erosie, fysieke verwering of chemicaliën is meestal water nodig?
Voor welk proces, massaverspilling, erosie, fysieke verwering of chemicaliën is meestal water nodig?  Amerikaanse bedrijven kopen hout van illegale PNG-kap:NGO
Amerikaanse bedrijven kopen hout van illegale PNG-kap:NGO Hoe nauwkeurig is ons mentale beeld van onszelf?
Hoe nauwkeurig is ons mentale beeld van onszelf?
Hoofdlijnen
- Wat is het chromosoom aantal suikerriet?
- De wetenschap zegt:wat er gebeurt als onderzoekers fouten maken
- Wat gebeurt alleen in de Gonads -mitose of meiose?
- Dood aminozuur kankercellen?
- Hoe rifvissen de cyclus van de maan kunnen gebruiken om het geslacht van hun nakomelingen te manipuleren
- Wat controleert de Thymus -klier?
- Wat is de rol van celdeling bij het helpen van het lichaam om gezond te blijven?
- Morfologie is de studie van de?
- Wat is ongelijk verdeeld in de vrouwelijke cytokinese?
- Onderzoekers rapporteren bio-geïnspireerde selectieve antibiotica
- Zonlicht omzetten in brandstof:efficiëntere fotokathodes ontwikkelen

- Effect van kationtypes op elektrochrome eigenschappen van titaniumdioxide nanokristallen

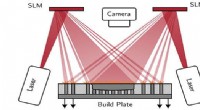
- Holografische bundelvorming om metallic 3D-printen een boost te geven
- Nieuw materiaal kan ademhalingsdruppels uit de lucht verwijderen

 Wetenschapper legt bewijs vast van dynamische seizoensactiviteit op een zandduin van Mars
Wetenschapper legt bewijs vast van dynamische seizoensactiviteit op een zandduin van Mars Met weinig training, algoritmen voor machinaal leren kunnen verborgen wetenschappelijke kennis blootleggen
Met weinig training, algoritmen voor machinaal leren kunnen verborgen wetenschappelijke kennis blootleggen Wat is 480 cm gelijk in meters?
Wat is 480 cm gelijk in meters?  Het effect van de islam op de wereldmaatschappij
Het effect van de islam op de wereldmaatschappij Wat is een zeldzame en mooie metimorfe steen gevormd uit kalksteen?
Wat is een zeldzame en mooie metimorfe steen gevormd uit kalksteen?  Middelbare scholieren met een handicap behalen betere resultaten in inclusieve academische instellingen
Middelbare scholieren met een handicap behalen betere resultaten in inclusieve academische instellingen  Als een lichaam zou versnellen met een snelheid die zijn massa gelijk maakt aan de normale massa op aarde, hoe lang zou het dan nodig hebben om te reizen voordat het de lichtsnelheid bereikt?
Als een lichaam zou versnellen met een snelheid die zijn massa gelijk maakt aan de normale massa op aarde, hoe lang zou het dan nodig hebben om te reizen voordat het de lichtsnelheid bereikt?  Wat is de suiker in een mengsel van en water?
Wat is de suiker in een mengsel van en water?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

