
Wetenschap
Hoe zijn de concentraties van waterstofionen en hydroxide gerelateerd in een waterige oplossing.
KW =[H+] [OH-] =1,0 x 10^-14 bij 25 ° C
Dit is wat dit betekent:
* Neutrale oplossing: In een neutrale oplossing zijn de concentraties van H+ en OH- gelijk. Dit gebeurt wanneer beide 1,0 x 10^-7 M zijn M.
* Zure oplossing: In een zure oplossing is de concentratie van H+ groter dan de concentratie van OH-. Dit betekent de [H+]> 1.0 x 10^-7 m en de [OH-] <1,0 x 10^-7 M.
* Basisoplossing: In een basisoplossing is de concentratie van OH- groter dan de concentratie van H+. Dit betekent de [OH-]> 1,0 x 10^-7 m en de [H+] <1,0 x 10^-7 M.
Sleutelpunten:
* Het product van [H+] en [OH-] is altijd gelijk aan KW, zelfs als de oplossing zuur of basic is.
* De pH -schaal, die de zuurgraad/basiciteit meet, is gerelateerd aan de concentratie van H+:
* pH =-log [H+]
* Lagere pH -waarden duiden op een hogere zuurgraad (meer H+).
* Hogere pH-waarden duiden op een hogere basiciteit (meer OH-).
Voorbeeld:
Als de concentratie van H+ in een oplossing 1,0 x 10^-5 m is, kan de concentratie OH- worden berekend met KW:
[OH-] =KW / [H+] =(1,0 x 10^-14) / (1.0 x 10^-5) =1,0 x 10^-9 m
 Welke temperatuur smelt kristallen in Fahrenheit?
Welke temperatuur smelt kristallen in Fahrenheit?  Onderzoek vindt een goede plek om betere cellulose-afbrekende enzymen te ontwikkelen
Onderzoek vindt een goede plek om betere cellulose-afbrekende enzymen te ontwikkelen Wordt ijzer gebruikt om koper uit oplossingen van zijn zouten te verdringen?
Wordt ijzer gebruikt om koper uit oplossingen van zijn zouten te verdringen?  Hoe haarkleuring werkt
Hoe haarkleuring werkt  Sommige chemicaliën die worden beschuldigd van de vernietiging van ozonlaag zijn?
Sommige chemicaliën die worden beschuldigd van de vernietiging van ozonlaag zijn?
 Ras, etnische minderheden worden kwetsbaarder voor bosbranden
Ras, etnische minderheden worden kwetsbaarder voor bosbranden De term van bosbehoud definiëren?
De term van bosbehoud definiëren?  Grote bedrijven in Australië zullen dit jaar hun impact op het milieu moeten rapporteren, maar dit alleen zal geen verandering teweegbrengen
Grote bedrijven in Australië zullen dit jaar hun impact op het milieu moeten rapporteren, maar dit alleen zal geen verandering teweegbrengen  Vervuild afvalwater in de prognose? Probeer een zonneparaplu
Vervuild afvalwater in de prognose? Probeer een zonneparaplu Arctische opwarming drie keer sneller dan de planeet, rapport waarschuwt
Arctische opwarming drie keer sneller dan de planeet, rapport waarschuwt
Hoofdlijnen
- Welk type molecuul is glycine?
- Hoe helpen mossen nieuwe biologische gemeenschappen te starten?
- Het rapport brengt problemen aan het licht die vrouwen zouden kunnen afkeren van de academische wetenschap
- Wat maakt een verhaal succesvol? Onderzoekers hebben een manier gevonden om dit te voorspellen
- Wat zijn de twee soorten cellen die bij Retina worden gevonden en wat hun functies?
- Hoe klimaatverandering planten zal beïnvloeden
- Waarom is transcriptie unidirectioneel?
- Hoe zit het met de volgende stukken die nucleotide -monomeer nucleïnezuren vormen?
- Wat moet een zaad nodig hebben voor kieming?
- Nieuwe studie vindt onnauwkeurigheden in arseentestkits in Bangladesh

- Nieuwe polymeermembraantechnologie verbetert de efficiëntie van het afvangen van kooldioxide

- Hoe met stikstof gedoteerde fluorescerende koolstofstippen bijdragen aan de strijd tegen ziekten
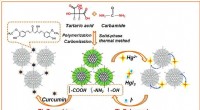
- Nieuw elektrodeontwerp kan leiden tot krachtigere batterijen
- Behandelde superlegeringen vertonen ongekende hittebestendigheid

 Hoe gevoelig is het klimaat voor verhoogde kooldioxide? Wetenschappers zoeken steeds meer naar het antwoord
Hoe gevoelig is het klimaat voor verhoogde kooldioxide? Wetenschappers zoeken steeds meer naar het antwoord Definitie van Phases of the Moon
Definitie van Phases of the Moon  Duizenden komen opdagen voor banen bij Amazon-magazijnen in Amerikaanse steden (update)
Duizenden komen opdagen voor banen bij Amazon-magazijnen in Amerikaanse steden (update)  Welke vaardigheden gebruiken wetenschappers om te studeren over de natuurlijke wereld?
Welke vaardigheden gebruiken wetenschappers om te studeren over de natuurlijke wereld?  Wat is een kort antwoord voor hoe wolken zich vormen?
Wat is een kort antwoord voor hoe wolken zich vormen?  Waarom is recombinant DNA een nieuwe vorm van DNA?
Waarom is recombinant DNA een nieuwe vorm van DNA?  Hoe kan ik de totale zonsverduistering veilig en effectief bekijken?
Hoe kan ik de totale zonsverduistering veilig en effectief bekijken?  Wanneer begon bodemerosie in Australië?
Wanneer begon bodemerosie in Australië?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

