
Wetenschap
Hebben vloeistoffen de grootste ruimtes tussen deeltjes zodat ze kunnen worden gecomprimeerd?
Hier is een uitsplitsing:
* gassen: Deeltjes liggen ver uit elkaar en bewegen vrij, waardoor een aanzienlijke compressie mogelijk is.
* vloeistoffen: Deeltjes zijn dichter bij elkaar dan gassen, maar hebben nog steeds wat ruimte om te bewegen. Ze zijn minder samendrukbaar dan gassen, maar kunnen in een kleine mate worden gecomprimeerd.
* vaste stoffen: Deeltjes zijn strak verpakt en hebben zeer weinig ruimte om te bewegen. Ze zijn erg moeilijk te comprimeren.
Zie het zo:stel je een kamer vol mensen voor. Als de mensen ver uit elkaar staan (zoals gasmoleculen), kunt u ze gemakkelijk dichter bij elkaar duwen (het gas comprimeren). Als de mensen schouder aan schouder zijn (zoals vloeibare moleculen), kun je ze nog steeds een beetje persen, maar het zal veel moeilijker zijn. En als de mensen in stoelen zitten (zoals vaste moleculen), is er nauwelijks ruimte om ze te comprimeren.
 Welk type organische verbinding omvat altijd een carboxylgroep en een aminogroep?
Welk type organische verbinding omvat altijd een carboxylgroep en een aminogroep?  Gevaren van Argon
Gevaren van Argon  Noem enkele monosachariden met hun molecuulformule?
Noem enkele monosachariden met hun molecuulformule?  Voorbeelden van elementen zonder een stabiele elektronenconfiguratie
Voorbeelden van elementen zonder een stabiele elektronenconfiguratie  Bloedvlekken gebruiken op plaats delict om de leeftijd van een verdachte of slachtoffer te bepalen
Bloedvlekken gebruiken op plaats delict om de leeftijd van een verdachte of slachtoffer te bepalen
 Thuisbezorgd voedsel heeft enorme klimaatkosten. Dus welke keuken is de grootste boosdoener?
Thuisbezorgd voedsel heeft enorme klimaatkosten. Dus welke keuken is de grootste boosdoener? Dieren in de savanne Grasland
Dieren in de savanne Grasland  Een focus op eerlijkheid:onderzoek onderzoekt hoe kinderen reageren op ongelijkheid over de hele wereld
Een focus op eerlijkheid:onderzoek onderzoekt hoe kinderen reageren op ongelijkheid over de hele wereld  Rechtszaak:Asbest, gietvorm, dampen maken brandweerkazerne gevaarlijk
Rechtszaak:Asbest, gietvorm, dampen maken brandweerkazerne gevaarlijk Oost-Antarctische ijskap kent een geschiedenis van instabiliteit
Oost-Antarctische ijskap kent een geschiedenis van instabiliteit
Hoofdlijnen
- Hoe worden vissen aangepast aan de zee?
- Welke naam geven zoölogisten een subset van soorten?
- Welk deel van de cel heeft een uitgebreide netwerkmembranen met ribosomen op het oppervlak?
- Your Brain On: An All Nighter
- Hoe wordt een schaaldier een krab?
- Cellulaire ademhaling bij de mens
- Het is belangrijk om bij het trekken van conclusies uit wetenschappelijke informatie?
- Hoe erfelijke ziekten werken
- De functie van macromoleculen
- Onderzoekers maken waterstofbrandstof uit zeewater

- Kenniskloof gedicht in ons begrip van degradatie van ethaan
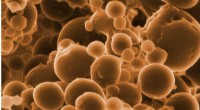
- Door licht aangedreven nano-organismen verbruiken CO2, milieuvriendelijke kunststoffen en brandstoffen maken

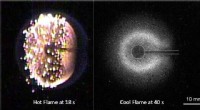
- Koele vlammen ontstoken in de ruimte
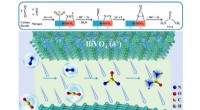
- Nieuwe katalysatoren verbeteren de efficiëntie van de ureumsynthese bij omgevingsomstandigheden
 Wat is oceanische convergentie?
Wat is oceanische convergentie?  Hoeveel planeten in het zonnestelsel hebben ring?
Hoeveel planeten in het zonnestelsel hebben ring?  Zadelvormig universum zou de algemene relativiteitstheorie kunnen ondermijnen
Zadelvormig universum zou de algemene relativiteitstheorie kunnen ondermijnen Wat zijn twee hernieuwbare en niet-hernieuwbare hulpbronnen die in Ierland worden gevonden?
Wat zijn twee hernieuwbare en niet-hernieuwbare hulpbronnen die in Ierland worden gevonden?  Simulaties laten zien hoe massieve zwarte gaten kunnen worden gevormd door fusies
Simulaties laten zien hoe massieve zwarte gaten kunnen worden gevormd door fusies Rapport gepubliceerd over nieuwe bedrijfsmodellen die bezuinigen op plastic voor eenmalig gebruik
Rapport gepubliceerd over nieuwe bedrijfsmodellen die bezuinigen op plastic voor eenmalig gebruik De meeste uiteenlopende plaatgrenzen bevinden zich langs de toppen van?
De meeste uiteenlopende plaatgrenzen bevinden zich langs de toppen van?  Klimaatverandering aanpakken bij een belangrijke bron:gebouwen
Klimaatverandering aanpakken bij een belangrijke bron:gebouwen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

