
Wetenschap
Waarom vormen groep 2 metalen ionen met een aanklacht?
Hier is een uitsplitsing:
* Elektronenconfiguratie: Groep 2 metalen hebben twee elektronen in hun buitenste energieniveau (S-orbitaal).
* octetregel: Atomen hebben de neiging om elektronen te winnen, verliezen of delen om een stabiele configuratie te bereiken met acht elektronen in hun buitenste schaal (octetregel).
* ionisatie: Om een stabiel octet te bereiken, verliezen groep 2 -metalen gemakkelijk hun twee buitenste elektronen, die kationen (positief geladen ionen) vormen met een +2 lading.
Voorbeeld:
* magnesium (mg) heeft een elektronenconfiguratie van 2, 8, 2. Het verliest zijn twee buitenste elektronen om een mg²⁺ ion te vormen met een stabiele configuratie vergelijkbaar met neon (2, 8).
Samenvattend:
De +2 lading op metaalionen van groep 2 komt voort uit hun neiging om twee elektronen te verliezen om een stabiele octet -elektronenconfiguratie te bereiken. Deze neiging wordt aangedreven door de elektrostatische aantrekkingskracht tussen de positief geladen kern en de negatief geladen elektronen, waardoor het energetisch gunstig is voor deze metalen om elektronen te verliezen en positief geladen ionen te worden.
 Foto-initiatoren voor tandvullingen, contactlenzen en kunstgebitten
Foto-initiatoren voor tandvullingen, contactlenzen en kunstgebitten Wat zijn de kosten in dollars van een enkel aluminiumatoom?
Wat zijn de kosten in dollars van een enkel aluminiumatoom?  Wat is de reden Alcoholen hebben een hoger kookpunt dan Alkanen met een vergelijkbare molaire massa?
Wat is de reden Alcoholen hebben een hoger kookpunt dan Alkanen met een vergelijkbare molaire massa?  Realtime dekking van de binnenkant van de hersenen mogelijk gemaakt
Realtime dekking van de binnenkant van de hersenen mogelijk gemaakt Waarom wordt ammoniumoxalaat toegevoegd aan de calciumcarbonaatoplossing?
Waarom wordt ammoniumoxalaat toegevoegd aan de calciumcarbonaatoplossing?
 Verkeersopstopping op Everest terwijl nog twee klimmers sterven bij het bereiken van de top
Verkeersopstopping op Everest terwijl nog twee klimmers sterven bij het bereiken van de top Uw kraanwater kan plastic, onderzoekers waarschuwen (Update)
Uw kraanwater kan plastic, onderzoekers waarschuwen (Update) Arseenveilig drinkwater naar het landelijke Californië brengen
Arseenveilig drinkwater naar het landelijke Californië brengen Wat is de definitie van aardse processen?
Wat is de definitie van aardse processen?  Rood tij rollen:Schadelijke algen blijken te gedijen in zowel hoge, omgevingen met weinig CO2
Rood tij rollen:Schadelijke algen blijken te gedijen in zowel hoge, omgevingen met weinig CO2
Hoofdlijnen
- Welk organel transporteren dingen rond de cel?
- Wat is de wetenschappelijke naam van appelzaad?
- Onderzoek met bacteriën brengt wetenschappers een stap dichter bij het maken van kunstmatige cellen met levensechte functionaliteit
- Hoe weet je of een plant onder water fotosynthese ondergaat?
- Onderzoek onthult hoe cellen zich herbouwen na mitose
- Hoe killifish-embryo's schijndood gebruiken om acht maanden van droogte te overleven
- Waarom de wetenschap ons niet echt kan vertellen of huisdieren goed zijn voor de gezondheid
- Gebruik van microscopen in Science
- Wanneer allel van een gen de aanwezigheid maskeert, welke vorm kan worden gezien in fenotype?
- Onderzoekers ontwikkelen methode die sterkere, meer plooibare metalen

- Lastige reactiereeks krijgt een grote boost van een stroomopstelling en statistieken
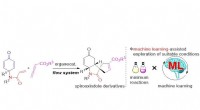
- Onderzoekers ontdekken C-H-bindingsactiveringsreacties bij lage temperatuur door foto-geïnduceerde middelen
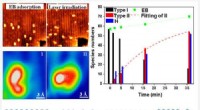
- Door ijzer gemedieerde kankercelactiviteit:een nieuw regulatiemechanisme

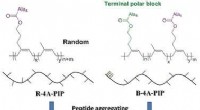
- Biomimetische strategie leidt tot sterke, recyclebaar rubber
 Hoe industriële bedrijven de deglobalisering kunnen overleven
Hoe industriële bedrijven de deglobalisering kunnen overleven  10 gekke uitvindingen die enorm beroemd werden
10 gekke uitvindingen die enorm beroemd werden  Korean Air laat 70 procent van het personeel met verlof
Korean Air laat 70 procent van het personeel met verlof Bepaling van het aantal moleculen kristallisatiewater per formule -eenheid natriumcarbonaat?
Bepaling van het aantal moleculen kristallisatiewater per formule -eenheid natriumcarbonaat?  Onderzoek toont aan hoe de Kleine IJstijd het Zuid-Amerikaanse klimaat beïnvloedde
Onderzoek toont aan hoe de Kleine IJstijd het Zuid-Amerikaanse klimaat beïnvloedde Griekenland registreert de warmste winter ooit gemeten:expert
Griekenland registreert de warmste winter ooit gemeten:expert  Een gouden laag zorgt voor scherpere beeldvorming en sneller scannen met röntgenstralen
Een gouden laag zorgt voor scherpere beeldvorming en sneller scannen met röntgenstralen  Hoe is het gebruik van radioactief verval in absolute dating vergelijkbaar met hoe je een klok hebt?
Hoe is het gebruik van radioactief verval in absolute dating vergelijkbaar met hoe je een klok hebt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

