
Wetenschap
Waarom geeft 1-chloorobutaan een neerslag terwijl i-jodopropaan niet wanneer ze reageren met natriumjodide in aceton, hoewel beide voornamelijk alkylhalide zijn?
Hier is de uitsplitsing:
* SN2 -reacties: Deze reacties omvatten een nucleofiel (zoals jodide -ion) die een elektrofiele koolstofatoom aanvalt, wat leidt tot verplaatsing van een vertrekkende groep (het halogenide).
* Groepsvermogen achterlaten: Het vermogen van de vertrekkende groep om te vertrekken is cruciaal voor de reactie om verder te gaan. jodide (I-) is een veel betere vertrekkende groep dan chloride (Cl-) . Dit komt omdat jodium groter en meer polariseerbaar is, waardoor de C-I-binding zwakker en gemakkelijker te breken is.
* De reactie:
* 1-chloorobutane: Hoewel de reactie kan optreden, is de C-Cl-binding relatief sterk, waardoor de reactie langzamer wordt. Het neerslag (vermoedelijk natriumchloride, NaCl) vormt zich langzaam.
* 1-joodopropaan: De C-I-binding is zwakker en het jodide-ion is een betere vertrekkende groep. De reactie verloopt veel sneller en vormt een sneller natriumjodide (NAI).
Samenvattend: Het verschil in reactiviteit is te wijten aan het verlaten van de Halogenen. Jodide is een betere vertrekkende groep dan chloride, wat leidt tot een snellere reactie met natriumjodide in aceton en een gemakkelijker gevormd neerslag.
Laat het me weten als je nog vragen hebt!
 Onderzoekers maken virusbestrijdende gezichtsmaskers
Onderzoekers maken virusbestrijdende gezichtsmaskers Wetenschappers bestuderen hoe de efficiëntie van pesticiden kan worden verbeterd
Wetenschappers bestuderen hoe de efficiëntie van pesticiden kan worden verbeterd  Wat gebeurt er als kaliumjodide wordt gemengd met kopersulfaat?
Wat gebeurt er als kaliumjodide wordt gemengd met kopersulfaat?  Kan de kleur van licht de kristalgroei beïnvloeden?
Kan de kleur van licht de kristalgroei beïnvloeden?  Wat zijn de kleuren van een vuur en hoe heet zijn ze?
Wat zijn de kleuren van een vuur en hoe heet zijn ze?
 Drones stijgen op naar wolken om het effect van ijsvorming op het klimaat te begrijpen
Drones stijgen op naar wolken om het effect van ijsvorming op het klimaat te begrijpen Wetenschappers schijnen licht op 66 miljoen jaar oud meteoriet-wildvuurmysterie
Wetenschappers schijnen licht op 66 miljoen jaar oud meteoriet-wildvuurmysterie  140 vermisten na gletsjerbreuken in Indiase Himalaya
140 vermisten na gletsjerbreuken in Indiase Himalaya Storm Nicholas verzwakt maar laat 450 achter, 000 huizen in Texas zonder stroom (update)
Storm Nicholas verzwakt maar laat 450 achter, 000 huizen in Texas zonder stroom (update) Wereldmeren verliezen snel zuurstof naarmate de planeet opwarmt
Wereldmeren verliezen snel zuurstof naarmate de planeet opwarmt
Hoofdlijnen
- Kunnen milieutoxines de biologische klok verstoren?
- Hoe beïnvloedt biologie het dagelijks leven van een persoon?
- Waarom zouden wetenschappers communiceren met andere wetenschappers?
- Verwacht wordt dat AI de geheimen van niet-coderende genen zal ontrafelen
- Twee zijden van DNA -ladder zijn losjes aan elkaar verbonden door wat?
- Welke celstructuur heeft zuurstof nodig om zijn werk te doen?
- Wat vind je van DNA?
- Wat is een bacterieziekte veroorzaakt door besmet voedsel?
- Visa, MasterCard... DNA-kaart:wat zit er in je portemonnee?
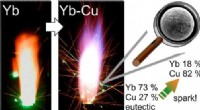
- Onderzoekers gebruiken zeldzame aardmetalen in legeringspoeders om groene, opvallende sterretjes te produceren
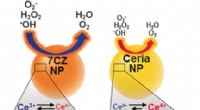
- Ceria-zirconia-nanodeeltjes als verbeterde multi-antioxidanten zijn effectief bij de behandeling van sepsis
- Een nieuwe tool om eiwitten aan en uit te zetten

- cel gedrag, ooit gehuld in mysterie, wordt geopenbaard in een nieuw licht

- Chemici creëren nieuwe diagnostische methode voor moeilijke klimatologische omstandigheden

 Snakeskin inspireert nieuwe, wrijvingsverlagend materiaal
Snakeskin inspireert nieuwe, wrijvingsverlagend materiaal Eerste stap naar elektronische DNA-sequencing:translocatie door grafeen-nanoporiën
Eerste stap naar elektronische DNA-sequencing:translocatie door grafeen-nanoporiën Honderdjarige stormen? Zo lang duren ze op Saturnus
Honderdjarige stormen? Zo lang duren ze op Saturnus  De hiaten in het SuperDARN-archief opvullen
De hiaten in het SuperDARN-archief opvullen Melkeiwit kan de gezondheid van bosbessen helpen verbeteren
Melkeiwit kan de gezondheid van bosbessen helpen verbeteren Een volk van dierenliefhebbers?
Een volk van dierenliefhebbers?  Wat is bijvoorbeeld een regulerend voedsel?
Wat is bijvoorbeeld een regulerend voedsel?  Wat is fosforzuur plus calciumhydroxide?
Wat is fosforzuur plus calciumhydroxide?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

