
Wetenschap
Waar hangt het smelt- en kookpunt van afhankelijk van?
1. Intermoleculaire krachten:
* Sterkte van intermoleculaire krachten: Sterkere intermoleculaire krachten vereisen meer energie om te overwinnen, wat leidt tot hogere smelt- en kookpunten. Deze krachten omvatten:
* waterstofbinding: Het sterkste type intermoleculaire kracht, gevonden in moleculen die H -gebonden zijn aan N, O of F.
* Dipole-dipole interacties: Optreden tussen polaire moleculen als gevolg van permanente dipolen.
* Dispersietroepen in Londen: Zwakste type, gevonden in alle moleculen vanwege tijdelijke schommelingen in elektronenverdeling.
* Type intermoleculaire krachten: Het aanwezige type kracht bepaalt zijn sterkte en dus het smelt-/kookpunt. Waterstofbinding is de sterkste, gevolgd door dipool-dipool en vervolgens de disperstroepen in Londen.
2. Moleculaire structuur:
* Grootte en vorm van moleculen: Grotere en complexere moleculen hebben een groter oppervlak, wat leidt tot sterkere dispersiekrachten in Londen en hogere smelt-/kookpunten.
* vertakking: Vertakking in moleculen vermindert het oppervlak en verzwakt intermoleculaire krachten, wat resulteert in lagere smelt-/kookpunten.
3. Druk:
* Externe druk: Verhoogde druk verhoogt in het algemeen het smeltpunt en het kookpunt. Dit komt omdat de druk moleculen dichter bij elkaar dwingt, waardoor het moeilijker is om intermoleculaire krachten te breken.
4. Onzuiverheden:
* Aanwezigheid van onzuiverheden: Onzuiverheden verstoren de reguliere opstelling van moleculen in een vaste of vloeibare, verzwakkende intermoleculaire krachten en verlagen van het smelt-/kookpunt.
5. Andere factoren:
* bindingssterkte: Covalente bindingen in een molecuul zijn typisch veel sterker dan intermoleculaire krachten, maar hun invloed op smelten en kookpunten is minder belangrijk.
* Moleculaire massa: Hogere moleculaire massa leidt in het algemeen tot hogere smelt- en kookpunten als gevolg van sterkere dispersiekrachten in Londen.
Samenvattend worden de smeltende en kookpunten van een stof bepaald door het samenspel van deze factoren, die uiteindelijk de sterkte beïnvloeden van de intermoleculaire krachten die de moleculen bij elkaar houden.
 Koolstofbeprijzing werkt, blijkt uit groot metaonderzoek
Koolstofbeprijzing werkt, blijkt uit groot metaonderzoek  Mensen beschouwen de gezondheidsrisico's van de binnenlucht als groter dan wat wordt gesuggereerd door onderzoeksgegevens
Mensen beschouwen de gezondheidsrisico's van de binnenlucht als groter dan wat wordt gesuggereerd door onderzoeksgegevens Hoe planten de poriën waardoor ze ademen spreiden
Hoe planten de poriën waardoor ze ademen spreiden  Wat verbruikt de meeste elektriciteit in een huis?
Wat verbruikt de meeste elektriciteit in een huis?  Elke tropische boomsoort is gespecialiseerd in het verkrijgen van de voedingsstoffen die het nodig heeft
Elke tropische boomsoort is gespecialiseerd in het verkrijgen van de voedingsstoffen die het nodig heeft
Hoofdlijnen
- Olifantenstroperij in Afrika neemt af, maar ivoorvangsten nemen toe:studie
- Nieuw deep learning-model gebruikt video om de embryonale ontwikkeling te meten
- De verschillen tussen monosachariden en polysachariden
- Welke banen kun je krijgen met een graad in biologie?
- Nadat de wetenschapper een hypothese heeft gemaakt die ze uitvoeren om gegevens te verzamelen?
- Nieuw onderzoek laat zien hoe verstoring van de tarwehandel de voedselzekerheid kan beïnvloeden
- Hoe vaak repliceren chromosomen in meiose?
- Waarom moet een gamete allel uit elk gen dragen?
- Wat gebeurt er als we zin orgel hebben?
- Gesimuleerd microzwaartekrachtsysteem gemaakt om te experimenteren met materialen

- Nieuw katalysatorcomposiet vermindert het gebruik van zeldzame aardelementen
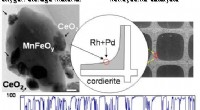
- Een bondgenoot voor legeringen:AI helpt bij het ontwerpen van hoogwaardig staal

- Onderzoekers ontwikkelen brandvertragende coating met hernieuwbare materialen

- Een materiaal dat kneuzingen als een huid
 Meerdere stellaire populaties gevonden in de cluster NGC 1866
Meerdere stellaire populaties gevonden in de cluster NGC 1866 Wat zijn de 8 temperatuurschalen?
Wat zijn de 8 temperatuurschalen?  Hoe de diversiteit van respiratoire chinonen de microbiële fysiologie beïnvloedt
Hoe de diversiteit van respiratoire chinonen de microbiële fysiologie beïnvloedt  Blauw licht voor RNA-controle
Blauw licht voor RNA-controle Doorbraak in het bestuderen van het enzym dat uiteindelijk het visgeursyndroom veroorzaakt
Doorbraak in het bestuderen van het enzym dat uiteindelijk het visgeursyndroom veroorzaakt Kwantumbronnen maken record-efficiëntie zonnecel met twee knooppunten mogelijk
Kwantumbronnen maken record-efficiëntie zonnecel met twee knooppunten mogelijk Onderzoekers zetten machine learning op weg naar kwantumvoordeel
Onderzoekers zetten machine learning op weg naar kwantumvoordeel LHCb:Correlaties tonen nuances van het deeltjesgeboorteproces
LHCb:Correlaties tonen nuances van het deeltjesgeboorteproces
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

