
Wetenschap
Wat zou moeilijker moeten zijn om een natriumion van een chloride- of kaliumion te scheiden?
$$F=k\frac{q_1q_2}{r^2}$$
waarbij \(F\) de kracht is, \(k\) de constante van Coulomb \((8,98\times10^9\text{ N}\cdot\text{m}^2/\text{C}^2)\ ), \(q_1\) en \(q_2\) zijn de grootten van de ladingen, en \(r\) is de afstand tussen de ladingen.
Natrium en kalium vormen beide +1 ionen, dus \(q_1\) is voor beide hetzelfde. Chloride-ion heeft een lading van -1, dus \(q_2\) is ook hetzelfde. Het verschil wordt alleen veroorzaakt door de afstand \(r\). De ionenstraal van \(Na^+\) en \(K^+\) zijn respectievelijk \(0,97 \AA\) en \(1,33\AA\). Omdat de straal van \(K^+\) ion groter is, is de afstand tussen \(K^+\) en \(Cl^-\) langer dan de afstand tussen \(Na^+\) en \(Cl ^-\).
Volgens de wet van Coulomb is de kracht tussen twee ladingen omgekeerd evenredig met het kwadraat van de afstand ertussen. Daarom wordt een sterkere aantrekkingskracht verwacht tussen \(Na^+\) en \(Cl^-\) ionen.
Daarom zou het moeilijker moeten zijn om een natriumion van een chloride-ion te scheiden dan een kaliumion van een chloride-ion.
 Wetenschappers vinden persistente organische verontreinigende stoffen in dierenbont
Wetenschappers vinden persistente organische verontreinigende stoffen in dierenbont Vroeg waarschuwingssysteem voor aardbevingen breidt zich uit naar Oregon, Washington
Vroeg waarschuwingssysteem voor aardbevingen breidt zich uit naar Oregon, Washington Het lange droog:de wereldwijde watervoorraden slinken
Het lange droog:de wereldwijde watervoorraden slinken De methaancyclus in wetland nam toe tijdens een oud broeikaseffect
De methaancyclus in wetland nam toe tijdens een oud broeikaseffect Kinderen zijn onze toekomst, en die van de planeet. Hier leest u hoe u ze kunt leren ervoor te zorgen
Kinderen zijn onze toekomst, en die van de planeet. Hier leest u hoe u ze kunt leren ervoor te zorgen
Hoofdlijnen
- Wiskundig model laat zien hoe een pitadder in het holst van de nacht zijn eten kan vinden
- Walviskarkas opgegraven van Australisch strand vanwege angst voor haaien
- Klimaatverandering kan het mariene milieu meer dan wat dan ook beïnvloeden
- Het verlichten van sojabladeren kan de voedselvoorziening stimuleren
- Wetenschappers vergroten het inzicht in hoe bloemen worden gevormd
- Nieuwe inzichten in hoe natuurlijke antioxidanten vet bestrijden
- Het verhaal van evolutie geschreven in fosfor
- Hoe kan embryonale ontwikkeling worden gebruikt als bewijs voor evolutie?
- Hoe maak je een 3D-celmembraamodel
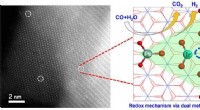
- Wetenschappers stellen redoxmechanisme voor water-gasverschuivingsreactie voor
- Duurzaam zand haalt vervuilende stoffen uit regenwater

- Assemblagetheorie zou goed nieuws kunnen zijn voor de ontdekking van medicijnen
- Onderzoek toont aan dat keramiek kan vervormen als metalen als het onder een elektrisch veld wordt gesinterd

- Onderzoekers leggen in realtime rondzwervende moleculaire fragmenten vast

 Welke zaden worden in banken opgeslagen? | Hoe dingen werken
Welke zaden worden in banken opgeslagen? | Hoe dingen werken  Eerste wetenschapper die zei dat alle planten uit cellen bestaan?
Eerste wetenschapper die zei dat alle planten uit cellen bestaan?  Stealth-blad verbergt hete voorwerpen voor nieuwsgierige infraroodogen
Stealth-blad verbergt hete voorwerpen voor nieuwsgierige infraroodogen Plotselinge overstromingen, stormvloedwaarschuwing terwijl Isaias de oostkust van de VS binnenstormt
Plotselinge overstromingen, stormvloedwaarschuwing terwijl Isaias de oostkust van de VS binnenstormt Welk soort licht gaat door een object?
Welk soort licht gaat door een object?  Hoeveel Australiërs lijden honger? Het land weet het niet zeker, en dat is een groot deel van het probleem
Hoeveel Australiërs lijden honger? Het land weet het niet zeker, en dat is een groot deel van het probleem  Studie brengt nanobody-structuur in kaart, wat leidt tot nieuwe manieren om mogelijk ziekten te bestrijden
Studie brengt nanobody-structuur in kaart, wat leidt tot nieuwe manieren om mogelijk ziekten te bestrijden Onderzoekers verbeteren de efficiëntie van goedkope zonnecellen
Onderzoekers verbeteren de efficiëntie van goedkope zonnecellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

