
Wetenschap
Zombie-scanning maakt de studie van peptide-receptor-interacties op het celoppervlak mogelijk
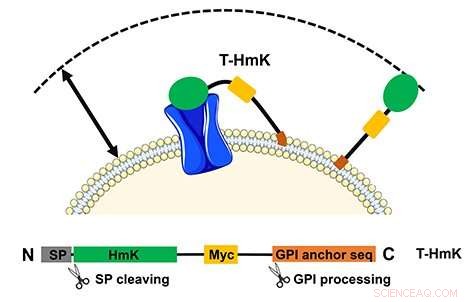
Het gebonden toxine (T-HmK) wordt vrij getrokken en gebonden aan een kaliumkanaal (blauw) dat tot expressie wordt gebracht in het celmembraan. Het reactievolume dat een T-HmK kan bezoeken (tweekoppige pijl) wordt bepaald door de gecombineerde lengtes van de flexibele peptidelinker, het GPI-anker, en de diameter van HmK-toxine. Het onderste paneel toont het ontwerp van het expressieconstruct. Krediet:UCI School of Medicine
Vroeger, biologisch actieve peptiden - kleine eiwitten zoals neurotoxinen en hormonen die inwerken op celreceptoren om de fysiologie te veranderen - werden gezuiverd uit inheemse bronnen zoals gif en vervolgens werden er panelen met varianten geproduceerd in bacteriën, of gesynthetiseerd, om de structurele basis voor receptorinteractie te bestuderen. Een nieuwe techniek genaamd zombie scanning maakt deze oudere processen overbodig.
Peptiden worden gebruikt voor medische therapie en om biologie te studeren, onder andere, maar hun productiekosten in tijd en geld worden steeds hoger.
"Als een peptide 30 residuen heeft, simpelweg elke site één keer veranderen vereist de synthese, zuivering en validatie van de gevouwen samenstelling van alle 30 varianten, een proces dat maanden en vele duizenden dollars vergt, " zei Steven A.N. Goldstein, MD, doctoraat, vice-kanselier voor Gezondheidszaken aan de Universiteit van Californië, Irvine, en onderscheiden professor in de UCI School of Medicine Departments of Pediatrics and Physiology &Biophysics.
Vandaag gepubliceerd in wetenschappelijke vooruitgang , de nieuwe studie onder leiding van Goldstein en Jordan H. Chill, doctoraat, een professor in de afdeling Scheikunde aan de Bar-Ilan Universiteit in Israël, onthult hoe onderzoekers celmachines konden kapen om de aanmaak van peptiden te vereenvoudigen, waardoor uitgebreide, snelle studies van structuur-functie en mechanisme om de specificiteit en affiniteit van actie te verbeteren, de belangrijke parameters voor therapeutische werkzaamheid.
"Omdat we de celmachinerie kapen om de peptiden op het celoppervlak te synthetiseren en met de receptor weer te geven, we dubben dit zombie-scannen, " zei eerste auteur Ruiming Zhao, doctoraat, een onderzoeker in het Goldstein-laboratorium.
"Door deze nieuwe techniek te gebruiken, peptideveranderingen zijn net zo eenvoudig als de synthese van plasmiden en vereisen slechts dagen werk en centen per construct. Dit stelt ons in staat om de rollen van veel sites met veel veranderingen in een veel kortere tijd tegen veel lagere kosten te bestuderen."
De studie, getiteld, "Tethered peptide-neurotoxinen vertonen twee blokkerende mechanismen in de K+-kanaalporie, net als hun ongebonden analogen, " schetst hoe de gecodeerde peptiden via een natuurlijk pad naar de buitenkant van de cel worden gekoppeld op een flexibele ketting. In dit geval, het receptordoelwit werd ook tot expressie gebracht vanuit een plasmide en kon worden gemodificeerd. De methode maakt ook studie mogelijk van interacties met lage affiniteit die anders niet haalbaar zouden zijn om te analyseren.
Met behulp van zombie-scanning, onderzoekers hebben de onverwachte ontdekking gedaan dat een peptide in klinische onderzoeken als immuunonderdrukker anders werkt dan ooit werd gedacht, onthullend dat deze familie van neurotoxinen twee mogelijke manieren van interactie met kaliumkanalen heeft in plaats van slechts één.
Chill en collega Netanel Mendelman, doctoraat, verbeterde de impact van deze bevindingen door de driedimensionale structuur van een geselecteerd neurotoxine op te helderen met behulp van nucleaire magnetische resonantie (NMR).
"Door honderden afstanden en hoeken tussen atomen in het peptide te schatten, we kennen nu de structuur ervan, een moleculaire context bieden voor deze opwindende resultaten, "zei Chill. "De twee bindende modi lijken een 'omdraaien' van het toxine of een herschikking van zijn atomaire structuur in te houden."
Alternatieve bindingsmodi zoals beschreven voor deze peptiden zijn een lastige verstorende factor in op structuur gebaseerd medicijnontwerp, benadrukt het belang van de bevindingen van dit rapport en toekomstige studies van het herkenningsproces tussen kanalen en remmende peptiden.
 Hoe de netto ionische vergelijking voor CH3COOH te schrijven terwijl deze met NaOH reageert
Hoe de netto ionische vergelijking voor CH3COOH te schrijven terwijl deze met NaOH reageert  Nieuw materiaal bootst kracht na, taaiheid van parelmoer
Nieuw materiaal bootst kracht na, taaiheid van parelmoer De tijd berekenen om water te verwarmen
De tijd berekenen om water te verwarmen Studie versnelt de transformatie van biobrandstofafval in bruikbare chemicaliën
Studie versnelt de transformatie van biobrandstofafval in bruikbare chemicaliën Raman-spectroscopie biedt een niet-invasieve manier om herprogrammering van cellen te volgen
Raman-spectroscopie biedt een niet-invasieve manier om herprogrammering van cellen te volgen
 Model voor het voorspellen van een sneeuwlaag in de bergen geeft een duidelijker beeld van de afvoer in het voorjaar, gevolgen van klimaatverandering
Model voor het voorspellen van een sneeuwlaag in de bergen geeft een duidelijker beeld van de afvoer in het voorjaar, gevolgen van klimaatverandering Verouderde Amerikaanse dammen vormen een risico voor duizenden
Verouderde Amerikaanse dammen vormen een risico voor duizenden Hevige regenval in de warme sector in China:studies en uitdagingen
Hevige regenval in de warme sector in China:studies en uitdagingen Matrix kan zorgen voor vitale kopertoevoer
Matrix kan zorgen voor vitale kopertoevoer Ambtenaren van Arctische landen ontmoeten elkaar te midden van zorgen over boren
Ambtenaren van Arctische landen ontmoeten elkaar te midden van zorgen over boren
Hoofdlijnen
- Heerlijke narcissen zijn super eenvoudig te kweken. Hier is hoe
- Hoe Rigor Mortis te onderscheiden van een Cadaveric Spasm
- Het kwantumfysica-concept van kritische massa
- Voorbeelden van genetische diversiteit
- Wat gebeurt er in de interfase van de celcyclus?
- Aanpassen aan fluctuerende temperaturen
- Monstervissen van de diepte
- Hetzelfde gen, verschillende paringstechnieken bij vliegen
- Insecten kunnen mensen leren omgaan met tegenslag
- Wetenschappers ontwikkelen nieuw materiaal voor brandstofcellen die langer meegaan
- Licht van zeldzame aarde:nieuwe kansen voor organische light-emitting diodes
- Nieuwe methode detecteert snel sporen van kleine moleculen
- Chemici identificeren giftige chemicaliën in fracking afvalwater

- Nieuwe optische waterstofsensoren elimineren het risico op vonken

 De complexe reis van rode bloedcellen door microvasculaire netwerken
De complexe reis van rode bloedcellen door microvasculaire netwerken Leid met empathie tijdens de COVID-19-crisis
Leid met empathie tijdens de COVID-19-crisis Simulatiemodel kan de klimaatvoetafdruk van olieproductie verkleinen
Simulatiemodel kan de klimaatvoetafdruk van olieproductie verkleinen Natuurkundigen controleren lichtverstrooiing in grafeen
Natuurkundigen controleren lichtverstrooiing in grafeen Een verplaatsbare antiprotonval om de geheimen van antimaterie te ontrafelen
Een verplaatsbare antiprotonval om de geheimen van antimaterie te ontrafelen Hoe het opgeloste potentieel te berekenen
Hoe het opgeloste potentieel te berekenen ATLAS Experiment bestudeert de dynamiek van top-quarks met een zeer hoog momentum
ATLAS Experiment bestudeert de dynamiek van top-quarks met een zeer hoog momentum Bellen gaan met de stroom mee:simulatie van het gedrag van vloeistoffen die door leidingen bewegen
Bellen gaan met de stroom mee:simulatie van het gedrag van vloeistoffen die door leidingen bewegen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

