
Wetenschap
Wat deed Bohr naar Atomic Theory?
1. Gekwantiseerde energieniveaus: Bohr stelde voor dat elektronen in atomen alleen specifieke, gekwantiseerde energieniveaus kunnen bezetten. Dit betekende dat elektronen tussen deze niveaus niet konden bestaan, in tegenstelling tot het klassieke model dat een continu bereik van energieën mogelijk maakte.
2. Planetair model: Bohr leende het idee van planetaire banen van het zonnestelsel en paste het toe op het atoom. Hij stelde voor dat elektronen de kern ronddraaien in specifieke cirkelvormige paden die 'stationaire toestanden' worden genoemd.
3. Quantum Jumps: Bohr legde uit dat elektronen van het ene energieniveau naar het andere konden gaan door fotonen van specifieke energieën te absorberen of uit te stoten. Deze overgangen werden "Quantum Jumps" genoemd.
4. Verklaring van atomaire spectra: Het model van Bohr legde met succes de waargenomen lijnspectra van waterstofatomen uit. Het model voorspelde dat elektronen fotonen van specifieke golflengten zouden uitzenden wanneer ze overgingen tussen energieniveaus, wat overeenkwam met de waargenomen spectrale lijnen.
Beperkingen van het Bohr -model:
Ondanks het succes had het Bohr -model beperkingen:
* Het kon de spectra van atomen met meer dan één elektron niet nauwkeurig voorspellen.
* Het verklaarde niet de fijne structuur van spectrale lijnen.
* Het kon geen rekening houden met de magnetische eigenschappen van atomen.
Betekenis:
Het Bohr -model was een cruciale stap om de kwantumkarakter van atomen te begrijpen. Het introduceerde het concept van gekwantiseerde energieniveaus en hielp bij het verklaren van de waargenomen spectrale lijnen van waterstof. Hoewel het beperkingen had, maakte het de weg vrij voor meer geavanceerde atoommodellen, zoals het kwantummechanische model, dat een vollediger beeld van de atomaire structuur bood.
 Onderzoekers observeren hoe Canadese en Californische regenboogforellen reageren op hogere temperaturen
Onderzoekers observeren hoe Canadese en Californische regenboogforellen reageren op hogere temperaturen  Beruchte studie naar de ‘donkere kant’ van de mensheid zou wel eens kunnen aantonen hoe we deze op afstand kunnen houden
Beruchte studie naar de ‘donkere kant’ van de mensheid zou wel eens kunnen aantonen hoe we deze op afstand kunnen houden  De geschiedenis van riviersediment suggereert dat het klimaatverandering was, geen Mongoolse invasie die Transoxanië heeft verdoemd
De geschiedenis van riviersediment suggereert dat het klimaatverandering was, geen Mongoolse invasie die Transoxanië heeft verdoemd Hoe heeft de geografie van Amerika gevolgen voor vroege mensen op zoek naar voedsel?
Hoe heeft de geografie van Amerika gevolgen voor vroege mensen op zoek naar voedsel?  Welk object heeft een lage albedo?
Welk object heeft een lage albedo?
Hoofdlijnen
- Hoe verschillen organismen van niet-levende dingen?
- Wat is het transport van een molecuul van binnenuit cel tot buiten genoemd?
- Pompoengenomen gesequenced, ongewone evolutionaire geschiedenis onthullen
- Hoe wordt urobilinogeen gevormd?
- Genetische aandoeningen: definitie, oorzaken, lijst met zeldzame en veel voorkomende ziekten
- Toont een dichotome sleutel evolutionaire relaties tussen organismen?
- Wat moet algen groeien?
- Onderzoek toont verschillen in energieverteerbaarheid tussen zeugen en gelten
- Onderzoekers ontsluiten mogelijk pad om vleesetende bacteriën te behandelen
- Onderzoekers ontdekken de oorsprong van bijna-ultraviolette en zichtbare absorptiekenmerken van Ti:saffierlaserkristallen
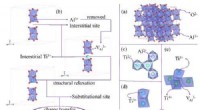
- Verbetering van de prestaties van een thermo-elektrisch materiaal door selectieve atomen gedeeltelijk te vervangen door kationen

- Ammoniak voor brandstofcellen

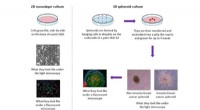
- Nieuw inzicht in hoe stamcellen interageren met borstkankercellen
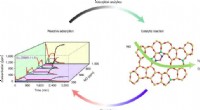
- Ingenieurs lossen mysterie op van de relatie tussen structuur en eigenschappen in katalysatoren voor emissiebeheersing
 Wat bepaalt de hoeveelheid chemische energie die een stof heeft?
Wat bepaalt de hoeveelheid chemische energie die een stof heeft?  Wetenschappers vinden een regel om nieuwe supergeleidende metaalhydriden te voorspellen
Wetenschappers vinden een regel om nieuwe supergeleidende metaalhydriden te voorspellen Eerste zomerdag juichen? Niet in Phoenix, aangezien de temperatuur 119 bedraagt
Eerste zomerdag juichen? Niet in Phoenix, aangezien de temperatuur 119 bedraagt  Magnetisme onder het vergrootglas
Magnetisme onder het vergrootglas Welke criteria bepalen of een heterogeen mengsel botst of suspensie is?
Welke criteria bepalen of een heterogeen mengsel botst of suspensie is?  Hoe het volume van een silo te berekenen
Hoe het volume van een silo te berekenen  Zelfbevloeiende grond kan de landbouw transformeren
Zelfbevloeiende grond kan de landbouw transformeren Wat begint chemische verwering?
Wat begint chemische verwering?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

