
Wetenschap
Waarom is water (H2O) een vloeistof bij kamertemperatuur, terwijl ammoniak (NH3) gastemperatuur?
Hier is een uitsplitsing:
Water (H₂o):
* Sterkere intermoleculaire krachten: Watermoleculen zijn polair, wat betekent dat ze een enigszins positief uiteinde hebben (waterstof) en een enigszins negatief uiteinde (zuurstof). Hierdoor kunnen ze sterke waterstofbruggen met elkaar vormen.
* waterstofbinding: Waterstofbindingen zijn een type sterke dipool-dipoolinteractie waarbij een waterstofatoom gebonden is aan een sterk elektronegatief atoom (zoals zuurstof) een binding vormt met een elektronegatief atoom in een aangrenzend molecuul.
* Hoog kookpunt: De sterke waterstofbindingen vereisen veel energie om te breken, wat leidt tot een relatief hoog kookpunt van 100 ° C.
ammoniak (NH₃):
* Zwakkere intermoleculaire krachten: Hoewel ammoniak ook een polair molecuul is, vormt het zwakkere waterstofbruggen dan water. Dit komt omdat het stikstofatoom minder elektronegatief is dan zuurstof, wat leidt tot zwakkere attracties tussen moleculen.
* Lower kookpunt: De zwakkere intermoleculaire krachten vereisen minder energie om te breken, wat resulteert in een veel lager kookpunt van -33,34 ° C.
kamertemperatuur:
Omdat kamertemperatuur meestal ongeveer 20-25 ° C is, houden de sterke waterstofbindingen van water het in een vloeibare toestand. Aan de andere kant laten ammoniaks zwakkere intermoleculaire krachten het als een gas bij kamertemperatuur bestaan.
Samenvattend: De sterke waterstofbindingen van het water zijn verantwoordelijk voor zijn vloeibare toestand bij kamertemperatuur, terwijl de zwakkere waterstofbindingen van ammoniak leiden tot zijn gasvormige toestand.
 Hoe beïnvloedt verwarming of koeling metaal?
Hoe beïnvloedt verwarming of koeling metaal?  Hebben de kristallen die uit een oplossing zijn neergeslagen unieke kristalvormen?
Hebben de kristallen die uit een oplossing zijn neergeslagen unieke kristalvormen?  Hoe kunnen reactiekrachten in actie worden geïdentificeerd?
Hoe kunnen reactiekrachten in actie worden geïdentificeerd?  Nieuw algoritme helpt vergeten figuren onder Da Vinci-schilderij te ontdekken
Nieuw algoritme helpt vergeten figuren onder Da Vinci-schilderij te ontdekken Waarom moet de gascontainer een zeer sterke en dikke metalen container zijn?
Waarom moet de gascontainer een zeer sterke en dikke metalen container zijn?
 Science Fair Projectideeën met vis
Science Fair Projectideeën met vis  Heeft klimaatverandering invloed op de vastgoedprijzen? Alleen als je erin gelooft
Heeft klimaatverandering invloed op de vastgoedprijzen? Alleen als je erin gelooft  Lijst met dingen Dr. George Carver uitgevonden met pinda's
Lijst met dingen Dr. George Carver uitgevonden met pinda's In verschroeiende droogte, Californische boeren verscheuren kostbare amandelbomen
In verschroeiende droogte, Californische boeren verscheuren kostbare amandelbomen Eén manier waarop ecosystemen reageren op veranderingen in het milieu?
Eén manier waarop ecosystemen reageren op veranderingen in het milieu?
Hoofdlijnen
- Een 3D-model van een dier of plant maken Cell
- Onderzoekers leren hoe bacteriën hun beschermende buitenmembranen beschermen
- Hoe bacteriën hun onzichtbaarheidsmantels hechten aan de immuunafweer
- 'Wat als er een stoere Barbie bestond?' Barbie's genderpolitiek onderzocht
- Waarom is het belangrijk om basisonderdelen van de cel te kennen?
- 3D-analyse van hondenfossielen werpt licht op het debat over domesticatie
- Verschil tussen triglyceriden en fosfolipiden
- Waar wordt messenger-RNA gehecht tijdens de eiwitconstructie?
- Welke wetenschapper bestudeert Flora?
- Nieuwe technologie maakt snelle eiwitsynthese mogelijk

- Een organokatalysator gebruiken om de polymerisatie te stereocontroleren
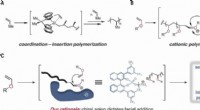
- Leren van fotosynthese:synthetische circuits kunnen lichtenergie oogsten
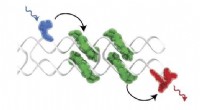
- Nieuw materiaal bootst kracht na, taaiheid van parelmoer

- Antimalariamiddelen bieden een scala aan nieuwe herbiciden

 Het gebrek aan dikke bodems op steile heuvels is een voorbeeld van hoe de bodemontwikkeling wordt beïnvloed?
Het gebrek aan dikke bodems op steile heuvels is een voorbeeld van hoe de bodemontwikkeling wordt beïnvloed?  Is aluminium gewikkeld rond een appel een fysieke verandering?
Is aluminium gewikkeld rond een appel een fysieke verandering?  Biometrische spiegel wijst op tekortkomingen in kunstmatige intelligentie
Biometrische spiegel wijst op tekortkomingen in kunstmatige intelligentie Hoe beïnvloeden windmolens de atmosfeer?
Hoe beïnvloeden windmolens de atmosfeer?  Denk je erover om rustig te stoppen? Hier leest u waarom (en hoe) u in plaats daarvan met uw baas moet praten
Denk je erover om rustig te stoppen? Hier leest u waarom (en hoe) u in plaats daarvan met uw baas moet praten  Wat zijn breuklijnen en welke manier bewegen tektonische platen bij de fouten?
Wat zijn breuklijnen en welke manier bewegen tektonische platen bij de fouten?  Wat zijn de energieproducenten in de cel?
Wat zijn de energieproducenten in de cel?  Het leven in de langzame rijstrook
Het leven in de langzame rijstrook
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

